Tampilkan postingan dengan label gandum 3. Tampilkan semua postingan
Tampilkan postingan dengan label gandum 3. Tampilkan semua postingan
Rabu, 10 Mei 2023
inginan evaporasi daun sangat kecil. Meskipun demikian, daun
mempertahankan stomata tetap terbuka untuk memungkinkan penyerapan
CO2
. Perbedaan laju fiksasi CO2
dapat memicu perbedaan ketahanan
stomata daun yang dapat diukur dengan porometer.
Pola cekaman suhu tinggi dapat bervariasi antardaerah tumbuh gandum.
Faktor utama yang menjelaskan interaksi genotipe dan lingkungan adalah
kelembaban relatif (RH). Pada wilayah dengan RH rendah, seperti Kawasan
Timur negara kita kurangnya ketersediaan kultivar yang secara fisiologis toleran
suhu tinggi merupakan faktor pembatas hasil biji yang tinggi. Sementara pada
kondisi lingkungan dengan RH tinggi seperti di Kawasan Barat negara kita ,
tekanan penyakit dapat menjadi faktor pembatas tambahan dan mungkin lebih
serius. Penurunan suhu kanopi dapat menjadi kriteria seleksi tidak langsung
yang berpotensi kuat dalam lingkungan RH rendah, sedangkan ketahanan
stomata dan membran termostabilitas dapat diterapkan di semua lingkungan.
PENDEKATAN AGRONOMIS UNTUK MENGURANGI
PENGARUH CEKAMAN SUHU TINGGI
Pertumbuhan tanaman yang optimal membutuhkan pasokan air, hara, dan
radiasi matahari. Bila suhu udara meningkat, permintaan terhadap sumber daya
air dan hara meningkat karena tingginya laju metabolisme, pertumbuhan, dan
evapotranspirasi (Rawson 1986). Ketika sumber daya seperti air dan hara dibatasi
oleh tekanan panas, ukuran organ tanaman seperti luas daun, jumlah anakan,
dan gabah berkurang (Fischer 1984). Tingkat sensitivitas proses metabolisme
terhadap pengaruh suhu tunggi di lapangan, ditambah dengan berkurangnya
umur tanaman pada suhu tinggi (Midmore et al. 1984), menjelaskan mengapa
hasil gandum sangat terkait dengan total biomassa tanaman pada lingkungan
suhu tinggi. Interaksi ini membuat manajemen pengelolaan tanaman menjadi
penting untuk mempertahankan hasil panen gandum di lingkungan suhu tinggi.
pemakaian pupuk organik seperti pupuk kandang dapat memperbaiki
kondisi fisik dan kimia tanah, serta membantu menjaga kelembaban tanah (Sattar
and Gaur 1989; Tran-Thuc-Son et al. 1995). Pemberian pupuk organik sebanyak
10-15 t/ha di awal pertanaman meningkatkan hasil panen gandum selama tiga
musim tanam berturut-turut, bila dikombinasikan dengan pemberian pupuk
anorganik N pada kondisi panas dan kelembaban tinggi di Bangladesh (Mian et
al. 1985). Pada kondisi suhu tinggi, penguapan pupuk N dalam bentuk NH3
lebih
cepat dibandingkan dengan aplikasi setara N dalam bentuk pupuk organik
seperti pupuk kandang (Tran-Thuc-Son et al. 1995).
pemakaian kombinasi pupuk organik dan anorganik terhadap hasil
gandum dievaluasi dalam percobaan lapangan di Pakistan (Syah et al. 2010).
Hasil penelitian menunjukkan bahwa kombinasi pemberian 25% N dari kotoran
sapi, 25% N dari kotoran ayam, dan 50% N dari pupuk urea cenderung
memberikan hasil lebih tinggi dibandingkan dengan 100% N asal urea (Tabel 3).
Mulsa jerami juga berpotensi memperbaiki cekaman suhu tinggi dengan
mengurangi laju penguapan kelembaban tanah dan meningkatkan laju infiltrasi
dan menurunkan suhu tanah (Lal 1975, Badaruddin et al. 1999). Suhu
permukaan tanah dapat melebihi suhu udara 10-15°C jika permukaan tanah
gundul dan intensitas radiasi matahari tinggi (Fischer 1984). Kondisi ini
menunjukkan hasil gandum di lingkungan yang hangat dapat ditingkatkan
dengan memodifikasi teknik budi daya. Secara keseluruhan, aplikasi pupuk
kandang memiliki efek terbesar dan paling konsisten terhadap hasil. Teknik
olah tanah minimum yang terkait dengan pemanfaatan sisa tanaman dan curah
hujan juga meningkatkan hasil gandum (Malik et. al. 2004).
Pola tanam padi-gandum merupakan sistem tanam yang paling penting di
India dan China. Petani menanam padi di lahan sawah pada musim hujan dan
diikuti oleh gandum pada musim dingin. Padi dibudi dayakan setelah tanah
diolah sempurna (OTS) dan gandum dibudi dayakan tanpa olah tanah (TOT).
Berkembangnya gandum dengan teknik TOT didukung oleh pengembangan
varietas toleran herbisida (Gambar 2). Produktivitas gandum cenderung lebih
tinggi pada teknik TOT dibanding OTS.
Pertumbuhan gandum pada kondisi suhu tinggi sangat sensitif terhadap
manajemen pengelolaan tanaman. Pendekatan terpadu yang merupakan
kombinasi beberapa teknik budi daya yang sinergis dapat meningkatkan
pertumbuhan tanaman melalui peningkatan ketersediaan air dan hara bagi
tanaman. Pendekatan terpadu ini dapat dipilah untuk wilayah dengan cekaman
suhu tinggi serta kelembaban tinggi dan wilayah dengan suhu tinggi serta
kelembaban rendah.
KESIMPULAN
Tanaman gandum memberikan produksi optimal pada kisaran suhu udara 10-
20o
C dengan bulan kering (<100 mm/bulan) pada periode akhir sebelum panen.
Rendahnya potensi hasil pada daerah berelevasi rendah erat kaitannya dengan
respon tanaman terhadap suhu udara. Suhu yang tinggi memperpendek tahap
vegetatif tanaman, sehingga potensi genetik tanaman tidak tercapai. Penurunan
suhu kanopi, ketahanan stomata pada daun bendera, dan laju fotosintesis
berhubungan dengan keragaan tanaman di lapangan di bawah cekaman suhu
tinggi. Penurunan suhu kanopi menunjukkan korelasi genetik yang tinggi dengan
hasil biji sehingga dapat digunakan dalam seleksi generasi awal. Budi daya
gandum tanpa olah tanah setelah padi sawah, pemakaian pupuk organik dan
mulsa jerami merupakan kombinasi beberapa teknik budi daya yang sinergis,
dapat meningkatkan pertumbuhan tanaman melalui peningkatan ketersediaan
air dan hara bagi tanaman.
Gandum (Triticum aestivum) merupakan komoditas pangan utama dunia yang
berasal dari daerah beriklim sedang (subtropik), yang saat ini menjadi pangan
alternatif di negara-negara tropis dalam bentuk tepung terigu dan menjadi
sumber karbohidrat kedua setelah padi. Tidak dapat dipungkiri bahwa tepung
terigu berperan penting mendukung ketahanan pangan dan diversifikasi
pangan. Hal ini memicu volume impor biji dan tepung terigu di negara kita
terus meningkat dari tahun ke tahun. Menurut Listiyarini (2016) konsumsi
gandum pada tahun 2011-2012 sebesar 6,25 juta ton, tahun 2012-2013 mencapai
6,95 juta ton, tahun 2013-2014 menjadi 7,16 juta ton, dan meningkat menjadi
7,36 juta ton pada tahun 2014-2015. Untuk memenuhi kebutuhan ini ,
pemerintah melakukan impor terutama dari negara Uni Eropa, Kanada, Rusia,
Australia, dan Ukraina. Pada tahun 2013-2014 impor gandum sebesar 7,39 juta
ton, tahun 2014-2015 mencapai 7,49 juta ton dan diproyeksikan tahun 2015-
2016 naik menjadi 8,10 juta ton.
Program penelitian gandum di negara kita dimulai pada tahun 1969, namun
waktu itu belum intensif. Pada tahun 1981 penelitian lebih intensif dan program
pemuliaan gandum dimulai sejak 1985 dengan mengevaluasi galur introduksi
dan seleksi populasi bersegregasi (Kusmana dan Subandi 1985, Gayatri et al.
1989, Dasmal et al. 1995). Kegiatan ini berlanjut yang kemudian dilepas dua
varietas gandum yang masing-masing diberi nama Timor dan Nias pada tahun
1993. Hasil penelitian memperlihatkan gandum dataran tinggi menghasilkan
lebih dari 3 t/ha.
Penelitian selanjutnya adalah uji multilokasi beberapa genotipe introduksi
dari India dan CIMMYT (International Maize and Wheat Improvement Center)
oleh beberapa lembaga penelitian dan perguruan tinggi. Pada 2003 telah dilepas
dua varietas gandum, yaitu Selayar dan Dewata. Varietas Selayar berasal dari
galur HAHN/2*WEAVER introduksi dari CIMMYT dan varietas Dewata berasal
dari galur DWR 162 introduksi dari India (Dahlan et al. 2003).
Pengembangan gandum di negara kita pernah diinisiasi oleh Departemen
Pertanian, Seameo-Biotrop, dan PT Bogasari Flours Mills, dikenal sebagai
Gandum 2000. Penelitian pengembangan ini dilakukan pada empat elevasi yaitu
> 1.000 m dpl (Tosari, Pasuruan, Jawa Timur), 800 m dpl (Nongkojajar, Pasuruan,
Jawa Timur), 300 m dpl (Seameo-Biotrop, Bogor), dan > 100 m dpl (Mojosari,
Jawa Timur) (Handoko 2007). Materi penelitian diintroduksi dari India, yaitu
DWR-162. Dalam program pemuliaan, materi genetik ini dirancang untuk toleran
suhu tinggi (heat toleran) dan merupakan cikal bakal varietas Dewata.
Selanjutnya, pengembangan gandum di negara kita dimulai setelah dilepas dua
varietas pada tahun 2003, yaitu Selayar dan Dewata.
Tulisan ini membahas proses pemuliaan gandum dalam pembentukan
varietas unggul gandum di negara kita .
KONSTITUSI GENETIK TANAMAN GANDUM
Gandum merupakan spesies dari genus Triticum, Tribe Triticeae, dan Famili
Poaceae. Triticeae merupakan Tribe dari famili Poaceae yang terdiri atas lebih
dari 15 genus dan 300 spesies, termasuk gandum dan barley. Genus Triticum
berkerabat dengan Hordeum, Avena, Secale, Zea, dan Oryza (Wittenberg 2004).
Spesies yang termasuk ke dalam genus Triticum dikelompokkan ke dalam
tiga kelas ploidi, yaitu diploid (2n=2x=14), tetraploid (2n=4x= 28), dan
heksaploid (2n=6x=42) (Gambar 1) (Wittenberg 2004, Fehr 1987, Sleper and
Poehlman 2006). Saat ini terdapat 11 spesies diploid, 12 spesies tetraploid, dan
enam spesies heksaploid yang sudah diidentifikasi dan dideskripsikan (Sleper
and Poehlman 2006). Namun hanya dua spesies dari genus Triticum yang
memiliki nilai ekonomis penting, yaitu T. aestivum dan T. turgidum. T. aestivum
merupakan gandum yang umum dikenal dan dimanfaatkan untuk bahan baku
roti. T. turgidum dikenal dengan gandum durum yang digunakan untuk pasta.
Wilson (1955) mengklasifikasikan gandum berdasarkan kegunaannya dan
dibedakan ke dalam gandum keras (hard wheat) yang memiliki kandungan
gluten dan protein tinggi, yang cocok untuk roti; gandum lunak (soft wheat)
memiliki kandungan gluten dan protein yang lebih rendah, cocok untuk kuekue kering, biscuit, crackers. Gandum durum memiliki kandungan gluten dan
protein yang sangat rendah, cocok untuk macaroni dan spaghetti. Fehr (1987)
mengklasifikasikan beberapa spesies Triticum berdasarkan kelas ploidinya
(Tabel 1).
Gandum adalah tanaman menyerbuk sendiri. Penyerbukan sendiri
memicu konstitusi gen tanaman di alam bebas bersifat homozigot pada
hampir semua lokus. Penyataan ini didasarkan pada sifat pasangan alel,
yaitu alel homozigot akan tetap homozigot jika mengalami penyerbukan sendiri.
Alel heterozigot akan mengalami penurunan heterozigositas akibat
penyerbukan sendiri.
Peningkatan homozigositas akibat penyerbukan sendiri bergantung pada
tingkat generasi segregasi dan jumlah gen yang berperan. Menurut Allard (1960),
tingkat homozigot dapat dihitung dengan persamaan [(2n – 1)/2n
]m x 100%,
dimana n adalah tingkat generasi segregasi dan m adalah jumlah pasangan gen
heterozigot. Berdasarkan penjabaran ini , Allard (1960) menyimpulkan
bahwa semakin banyak jumlah gen berbeda, semakin dibutuhkan tingkat
generasi lanjut untuk menghasilkan populasi homozigot.
JENIS GANDUM YANG DAPAT DI KEMBANGKAN
DI LINGKUNGAN TROPIS
Tidak semua jenis gandum dapat tumbuh dan berproduksi dengan baik di
lingkungan tropis, khususnya lingkungan tropis negara kita yang
agroekosistemnya sangat beragam. Menurut Sleper dan Poehlman (2006), dua
sifat yang menjadi faktor pembatas budi daya gandum yaitu:
1. sifat fisiologis, yang membatasi daya adaptasi gandum terhadap
perubahan iklim/agroekosistem, umumnya berhubungan dengan
vernalisasi, musim dingin dan respons terhadap fotoperiodisitas. Syarat ini
sangat menentukan jenis gandum dan program pemuliaan yang akan
dikembangkan. Vernalisasi merupakan aspek fisiologis yang menentukan
pertumbuhan gandum, apakah tipe musim semi (spring) atau musim dingin
(winter). Tipe gandum musim dingin (winter wheat) memerlukan periode
vernalisasi (pemaparan pada tahap kecambah pada suhu yang mendekati
beku) yang dibutuhkan sebelum pembungaan terjadi. sifat lain
adalah kemampuan tanaman untuk mengeras dan bertahan dalam kondisi
suhu dingin. Tipe gandum musim semi (spring wheat) tumbuh di daerah
subtropis utara, yang sensitif terhadap periode penyinaran dan berbunga
selama panjang hari menurun.
2. sifat kimia dan fisika dari glutein. sifat ini berkontribusi
terhadap pemakaian biji gandum untuk berbagai jenis makanan yang
berbeda. Keberagaman produk akhir gandum yang digunakan
membutuhkan kultivar dengan biji yang baik. Perbedaan genetik
mempengaruhi kualitas biji. Sebelum memulai program pemuliaan, pemulia
gandum harus mengenal kondisi cekaman yang membatasi produksi
gandum di lokasi yang akan ditanam. Juga perlu diidentifikasi sifat
kualitas gandum yang diinginkan pasar dan program pemuliaan untuk
menghasilkan kultivar yang sesuai.
Pembentukan dan perbaikan genetik gandum melalui program pemuliaan di
negara kita diawali dengan mengintroduksi galur-galur elit dari berbagai negara
yang dianggap cocok dengan agroekosistem tropis melalui lembaga
internasional seperti CIMMYT. negara kita tidak memiliki plasma nutfah lokal
sehingga untuk menjalankan program pemuliaan gandum perlu keragaman
genetik yang luas dari luar negeri untuk mendapatkan varietas gandum yang
adaptif pada agroekosistem tropis negara kita , khususnya dataran menengah –
rendah. Hasil evaluasi terhadap beberapa galur introduksi menunjukkan bahwa
untuk mendapatkan varietas gandum dataran rendah perlu tipe ideal tanaman
dengan jumlah anakan produktif tinggi, jumlah spikelet banyak, dan daun
bendera lebar (Nur et al. 2012).
Natawijaya (2012) mengemukakan bahwa penyebab utama rendahnya
produksi gandum pada dataran < 400 m dpl adalah viabilitas polen yang rendah.
Dari empat galur dan dua varietas yang diuji semuanya mengalami penurunan
viabilitas polen di Tajur (< 400 m dpl) dan varietas Dewata yang paling peka
(Gambar 2). Demikian pula yang diperlihatkan morfologi polen (Gambar 3).
Genotipe yang sensitif terhadap cekaman suhu tinggi di dataran rendah
menurun jumlah dan fertilitas polennya (Gambar 2 dan Gambar 3). Pada Gambar
2 terlihat penurunan jumlah dan fertilitas polen pada genotipe Selayar dan Rabe
di dua agroekosistem tidak berbeda nyata, yang berarti genotipe-genotipe
ini stabil untuk karakter ini. Hasil penelitian ini membuktikan adanya
mekanisme adaptasi untuk tetap mempertahankan penampilannya yang optimal
di lingkungan dengan cekaman suhu tinggi. Barnabas et al. (2008) menjelaskan
bahwa penurunan fertilitas polen dan kehampaan malai disebabkan oleh
terganggunya proses mikrosporogenesis dan mikrogametogenesis. Beberapa
protein yang berperan dalam proses ini telah terdenaturasi karena
pengaruh suhu tinggi.
Dari hasil pengujian adaptasi pada berbagai agroekosistem di negara kita
(elevasi tinggi, menengah, dan rendah) dipilih galur-galur yang memiliki potensi
hasil tinggi dan daya adaptasi yang bagus (toleran suhu tinggi) sebagai tetua
persilangan. Populasi baru yang dibentuk melalui persilangan diharapkan
memiliki keragaman genetik yang luas dengan ideotipe tanaman yang
mengandung karakter potensi hasil tinggi, kualitas biji lebih baik, toleran terhadap
cekaman suhu tinggi dan tahan terhadap hama dan penyakit. Pembentukan
populasi untuk menghasilkan galur-galur gandum tropis melalui persilangan
meliputi: 1) introduksi galur-galur elit dari berbagai negara; 2) adaptasi galur
untuk melihat potensi hasil dan toleransi terhadap suhu tinggi pada berbagai
agroekosistem; 3) persilangan (single cross dan konvergent breeding); 4 evaluasi
hasil persilangan melalui metode shuttle breeding.
1. Introduksi galur
Perbaikan genetik sifat agronomik tanaman dapat dilakukan melalui pemuliaan.
Pemuliaan konvensional telah menghasilkan beberapa varietas unggul. Melalui
introduksi galur-galur elite dari CIMMYT maupun dari beberapa negara lain
telah dihasilkan tujuh varietas gandum dengan daerah adaptasi pada ketinggian
> 1.000 m dpl (Tabel 2). Varietas yang dilepas pada tahun 2013-2014 merupakan
hasil Konsorsium Gandum Nasional.
2. Adaptasi galur
Untuk mendapatkan galur-galur potensial sebagai calon varietas unggul baru
yang adaptif pada ketinggian < 700 m dpl dan toleran cekaman suhu tinggi
perlu uji adaptasi khusus pada berbagai elevasi, khususnya pada elevasi
menengah-rendah (< 700 m dpl). Galur-galur yang terpilih dari uji adaptasi
akan digunakan dalam program persilangan untuk perbaikan sifat gandum
melalui program pemuliaan. Perbedaan lingkungan subtropik yang merupakan
asal tanaman gandum dengan lingkungan tropis, dimana tanaman gandum
akan diadaptasikan dan dikembangkan, memerlukan penelitian yang
komprehensif.
Pemuliaan gandum ke depan diarahkan untuk mendapatkan varietas
unggul toleran suhu tinggi pada ketinggian 500-800 mdpl. Kegiatan yang telah
berjalan hingga saat ini adalah mengadaptasikan beberapa varietas/galur
gandum dari berbagai negara pada berbagai ketinggian tempat dan
agroekosistem yang berbeda. Kegiatan ini juga bertujuan untuk menyeleksi
galur/varietas introduksi yang dapat dijadikan sebagai tetua persilangan gandum.
Beberapa hasil pengujian gandum pada elevasi > 1.000 m dpl (Cipanas, Jawa
Barat) dan elevasi < 400 m dpl (Seameo-Biotrop, Jawa Barat) disajikan pada
Gambar 4 dan 5.
Varietas Dewata merupakan hasil seleksi galur introduksi (Dwr-162) dari
India dengan karakter toleran suhu tinggi. Setelah dievaluasi pada dataran <
400 m dpl, galur ini ternyata peka terhadap lingkungan tropis. Evaluasi galurgalur dari beberapa negara (India, Turki, dan Slovakia) memperlihatkan satu
galur dari Slovakia memiliki karakter umur genjah. Setelah dievaluasi di
lingkungan tropis negara kita , ternyata galur ini memiliki umur yang dalam
(115 hari) pada lokasi dengan ketinggian 117 m dpl (Demaga,Bogor) dan (127
hari) lokasi dengan ketinggian 1.170 m dpl (Cipanas,Cianjur) (Altuhaish 2014).
3. Persilangan (single cross dan convergent breeding)
Perbaikan genetik gandum tropis melalui program pemuliaan memperlihatkan
hasil yang cukup baik, baik persilangan konvensional maupun mutasi (mutasi
biji dan variasi somaklonal) (Nur et al. 2013a). Terdapat dua metode persilangan
gandum di dataran rendah, yaitu metode dialel dan convergen breeding. Metode
dialel bukan bertujuan untuk melihat daya gabung umum dan daya gabung
khusus, namun lebih mengarah pada identifikasi kemampuan bunga jantan
untuk membuahi bunga betina. Demikian juga kemampuan bunga betina untuk
dibuahi pada kondisi cekaman suhu tinggi. Persilangan convergent breeding
adalah metode rekombinasi genetik yang bertujuan untuk menghimpun dan
memfiksasi gen-gen yang mengendalikan sifat-sifat yang dikehendaki. Daya hasil,
toleran suhu tinggi, dan tepung berkualitas tinggi sebagai kriteria merupakan
karakter kuantitatif yang ekspresinya sangat dipengaruhi oleh lingkungan.
Kemungkinan gen-gen yang mengendalikan karakter yang akan diperbaiki
tersebar di antara galur-galur introduksi yang diuji, sehingga perbaikan genetik
untuk karakter-karakter ini harus menggunakan pendekatan persilangan,
baik melalui single cross maupun convergent breeding. Prosedur persilangan
disajikan pada Gambar 6. Dari persilangan pada elevasi > 1.000 m dpl (SeameoBiotrop, Bogor) diperoleh kombinasi persilangan seperti disajikan pada Tabel 3.
Observasi populasi F1 dilakukan pada elevasi < 400 (Seameo–Biotrop,
Bogor) dengan penampilan tanaman seperti disajikan pada Gambar 7.
Dari hasil kombinasi persilangan single cross kerja sama Balitsereal dan IPB
di hasilkan masing-masing 30 galur potensial F6 turunan dari Oasis x HP 1744
dan Selayar x Rabe yang dapat dikembangkan pada dataran menengah (400-
700 m dpl) (Yamin 2014). Melalui convergent breeding dari hasil persilangan
telah dihasilkan populasi F3 (Nur 2014). Tahapan persilangan convergent
breeding disajikan pada Gambar 8.
Persilangan pada tahun I menggunakan enam galur tetua, yang terdiri atas
delapan kombinasi persilangan yang dilaksanakan pada kondisi optimal pada
elevasi > 1.000 m dpl di kebun Percobaan Balai Penelitian Tanaman Hias (Balithi)
di Cipanas. Persilangan pada tahun II menggunakan benih F1
dari delapan
kombinasi persilangan dari percobaan tahun I dilaksanakan di green house
Kebun percobaan Seameo-Biotrop pada elevasi 350 m dpl. Penanaman dilakukan
secara bersamaan di polybag. Prosedur pelaksanaan percobaan sama dengan
tahun I (Gambar 8).
Persilangan pada tahun III menggunakan benih F1 dengan latar belakang
enam genotipe tetua dari masing-masing kombinasi, dilaksanakan di green
house Kebun Percobaan IPB, Cikabayan, pada elevasi 170 m dpl. Tahun III
merupakan tahun terakhir proses fiksasi gen-gen dari seluruh latar belakang
genetik yang terlibat. Pengujian benih F1 dari delapan kombinasi persilangan
dengan latar belakang enam genotipe tetua dilaksanakan pada dua elevasi,
yaitu Malino > 1.000 m dpl dan rumah kaca Balitsereal 30 m dpl (Gambar 9).
Benih F2 kemudian dilanjutkan pengujiannya pada dua elevasi (Gambar 10).
Keragaman genetik genotipe persilangan “convergent breeding” generasi
F3 gandum berdasarkan marka SSR yang bersosiasi dengan suhu tinggi
ditampilkan sebagai gambar pohon filogenetik (Gambar 10). Hasil
pengelompokan pohon filogenetik dapat dibagi dalam dua kelompok yaitu
kelompok I yang terdiri atas genotipe segregan, Oasis, Guri 1 dan Guri 2 serta
kelompok 2 yang terdiri atas genotipe Tepoca/Rabe, HP1744, Selayar, Dewata
dan Alibey pada koefisien kemiripan genetik 0,3. Tingkat koefisien kemiripan
genetik yang rendah pada pengelompokan 57 genotipe gandum menunjukkan
peluang heterotik untuk menghasilkan persilangan dengan tingkat keragaman
yang tinggi. Seluruh genotipe kelompok 1 memiliki nilai jarak genetik yang jauh
terhadap genotipe kelompok 2 dengan nilai rata-rata diatas 0,6. Terdapat dua
kombinasi persilangan pada kelompok genotipe ini yang memiliki nilai
jarak genetik yang lebih tinggi (> 0,8). Jarak genetik tertinggi 0,84 yaitu antara
genotipe Rabe//MO88 dan segregan 6.C-1, dan antara varietas Dewata dan
segregan 5.B-6. Kedua kombinasi persilangan ini diharapkan dapat digunakan
untuk menghasilkan rekombinan-rekombinan dalam rangka meningkatkan
keragaman genetik gandum dimasa yang akan datang (Nur 2015b).
4. Evaluasi hasil persilangan melalui metode “Shuttle Breeding”
Perbaikan genetik gandum tropis melalui program pemuliaan memperlihatkan
hasil yang cukup baik, baik melalui persilangan konvensional maupun mutasi
(Nur et al. 2013). Program pemuliaan ini di ikuti oleh metode shutlle
breeding, yang merupakan pendekatan seleksi untuk memperluas daya adaptasi
tanaman. Shuttle breeding pada pemuliaan gandum adalah seleksi pada
lingkungan optimal dan suboptimumal secara bergantian. Ekspresi gen-gen
daya hasil terjadi secara optimal pada lingkungan optimal sehingga seleksi untuk
galur berdaya hasil tinggi dapat dilakukan, sedangkan seleksi untuk
mendapatkan galur-galur toleran dilakukan di lingkungan suboptimal (Ortiz et
al. 2007). Seleksi secara simultan pada beberapa kondisi lingkungan dapat
meningkatkan kemampuan adaptasi galur-galur gandum (Slafer and
Whitechurch 2001).
Metode ini pada awalnya dikembangkan antarinstansi penelitian. Sejumlah
besar materi genetik yang mempunyai potensi dapat mengatasi masalah dikirim
ke suatu wilayah, kemudian dievaluasi secara sistematik dengan melibatkan
berbagai pihak di wilayah ini . Materi genetik yang mampu bertahan dalam
lingkungan seleksi, selanjutnya dikembangkan, sedangkan materi genetik lainnya
dikembalikan ke institusi penyelenggara pemuliaan untuk keperluan perbaikan
genetik. Materi genetik yang telah diperbaiki dikirimkan kembali ke wilayah
bermasalah untuk mengetahui respons seleksi tahap lanjut. Proses ini
dapat terjadi berulang-ulang hingga diperoleh satu atau dua materi genetik
yang mantap untuk mengatasi suatu masalah. Shuttle breeding disajikan pada
Gambar 11.
Kelebihan metode shuttle breeding dalam merakit varietas untuk lingkungan
dengan cekaman tertentu adalah materi genetik yang digunakan dapat
dipertahankan jika salah satu lingkungan (cekaman sangat tinggi) memicu
materi genetik mati dan lingkungan optimal digunakan sebagai backup materi
genetik. Seleksi langsung pada lingkungan dengan cekaman berpotensi untuk
memaksimalkan ekspresi gen-gen yang dapat mengendalikan daya hasil
maupun daya adaptasi tanaman terhadap cekaman lingkungan (Ceccareli et
al. 2007).
Shuttle breeding menggunakan materi generasi awal dari program
pemuliaan. Seleksi tahap pertama dilakukan oleh pemulia untuk memilih individu
tanaman atau sekelompok tanaman yang memiliki karakter unggul berdasarkan
penilaian tertentu. Seleksi selanjutnya dilaksanakan berdasarkan cekaman pada
lingkungan target. Seleksi generasi selanjutnya dilakukan dengan
mengembalikan individu pada lingkungan optimal yang bertujuan untuk
perbanyakan benih untuk seleksi yang lebih luas. Hal ini dilakukan berulangulang hingga didapatkan materi genetik yang betul-betul adaptif pada
lingkungan bercekaman.
Di negara kita , pendekatan shuttle breeding untuk mendapatkan populasi
yang memiliki adaptasi luas dilakukan di dataran tinggi dan dataran menengah.
Dataran tinggi mewakili lokasi optimum, sedangkan dataran menengah- rendah
mewakili lokasi dengan cekaman suhu sedang-tinggi. Penanaman pada
lingkungan optimum bertujuan untuk menginduksi ekspresi gen daya hasil
sehingga seleksi dilakukan berdasarkan daya hasil. Penanaman di lingkungan
dengan cekaman suhu tinggi bertujuan untuk menginduksi ekspresi gen
toleransi suhu tinggi, sehingga seleksi dilakukan berdasarkan indeks sensitivitas
terhadap suhu tinggi (Natawijaya 2012, Febrianto 2014, Wardani 2014, Yamin
2014 ).
Menurut Rao (2001), adaptasi tanaman terhadap lingkungan dapat
diperbaiki dengan dua pendekatan umum, yaitu perubahan lingkungan
pertumbuhan dan pengembangan genotipe tanaman berdaya hasil tinggi dan
toleran cekaman. Gabungan pendekatan ini paling efektif. Peningkatan
hasil panen melalui pemuliaan tanaman umumnya disebabkan oleh: (1)
perubahan agronomi melalui perbaikan adaptasi genetik untuk mengatasi
masalah biotik dalam produksi tanaman (misalnya, hama dan penyakit) dan
abiotik (misalnya, suhu, kekeringan, kahat dan keracunan hara dan salinitas),
dan (2) peningkatan potensi hasil genetik di atas kultivar pembanding pada
lingkungan yang sama (Evans 1993, Miflin 2000).
Daya hasil, toleran suhu tinggi, dan tepung berkualitas tinggi merupakan
karakter kuantitatif sehingga ekspresinya dipengaruhi oleh lingkungan. Selain
itu kemungkinan gen-gen yang mengendalikan karakter yang akan diperbaiki
tersebar di antara galur-galur introduksi yang diuji, sehingga perbaikan genetik
untuk karakter-karakter ini harus menggunakan pendekatan persilangan,
baik melalui single cross maupun convergent breeding. Setiap pendekatan
persilangan ini evaluasi turunannya diikuti dengan metode shuttle
breeding. Convergent breeding adalah salah satu metode rekombinasi genetik
yang bertujuan untuk menghimpun dan memfiksasi gen-gen yang
mengendalikan sifat-sifat yang dikehendaki ke dalam satu genotipe (Nur 2014).
Varietas yang dihasilkan melalui pendekatan ini memiliki karakter ideal.
Gandum (Triticum aestivum) merupakan tanaman subtropik yang telah menjadi
pangan alternatif utama di negara-negara tropis, termasuk negara kita . Gandum
diintroduksikan ke negara kita pada awal abad XVIII pada masa pemerintahan
kolonial Belanda. Benih gandum didatangkan dari Jepang, China, dan Iran untuk
selanjutnya ditanam di Cirebon, Jakarta dan Semarang. Selain Belanda, bangsa
Portugis juga mengintroduksikan gandum untuk memenuhi kebutuhan pokok
warga Portugis yang tinggal di Pulau Timor (Bahar dan Kaher 1989 dalam
Welirang 2015). Di negara kita , gandum dapat dibudidayakan di daerah dengan
ketinggian >900m dpl dengan suhu udara optimum rata-rata 22-240
C (Leonard
dan Martin 1963). Fischer (1980) mengemukakan bahwa jenis tanaman gandum
yang sesuai dikembangkan di negara kita adalah gandum musim semi (spring
wheat) yang tumbuh pada kisaran suhu antara 4-310
C, dengan rata-rata 20-
240
C.
Curtis (1988) membagi negara di daerah tropis untuk kesesuaian gandum
menjadi dua tipe lingkungan utama yaitu: 1) wilayah dengan suhu udara tinggi,
kelembaban udara rendah, periode tumbuh pendek, dan infestasi penyakit
yang kurang; 2) wilayah dengan suhu dan kelembaban udara tinggi, periode
tumbuh pendek, dan penularan penyakit agak dominan. Zaini et al. (1990)
melaporkan bahwa secara umum wilayah timur negara kita mewakili tipe
lingkungan yang pertama, sedangkan wilayah negara kita barat mewakili tipe
lingkungan kedua. Oleh karena itu, gandum berpeluang lebih besar untuk
dikembangkan di wilayah negara kita timur.
Pengembangan jenis gandum spring wheat di negara kita sangat terbatas
pada daerah dengan ketinggian >1.000 m dpl, sehingga perlu diarahkan pada
ketinggian <1.000 m dpl. Masalah yang dihadapi pada penanaman gandum di
lokasi dengan ketinggian < 1.000 m dpl adalah cekaman suhu tinggi. Menurut
Peet dan Willits (1998), suhu di atas 10-15oC dianggap sebagai cekaman suhu
tinggi pada tanaman gandum. Suhu tinggi berpengaruh terhadap kerusakan
bahkan kematian sel tanaman gandum beberapa menit setelah terpapar suhu
tinggi (Schoffl et al. 1999).
Walaupun daerah yang sesuai telah teridentifikasi, pengembangan gandum
tetap menghadapi berbagai kendala, diantaranya kondisi lingkungan tumbuh
di negara kita termasuk tropis, sehingga membutuhkan waktu adaptasi yang
cukup lama untuk menilai penampilan dan potensi hasil gandum (Nur 2013).
Selain itu, penguasaan teknologi gandum mulai dari hulu yaitu teknk budi daya
sampai ke hilir (prosessing) belum sepenuhnya dikuasai oleh petani maupun
petugas pertanian di lapangan. Gandum sebagai tanaman subtropik, bila
dikembangkan di daerah tropik, maka terbatas pada dataran tinggi dan akan
bersaing dengan tanaman hortikultura yang selama ini dibudidayakan oleh
petani secara terus-menerus.
Tulisan ini membahas perkembangan perakitan varietas gandum di
negara kita , yang meliputi pengelolaan sumberdaya genetik, dinamika litbang
gandum serta penyediaan benih sumber gandum.
SUMBER DAYA GENETIK
Sumber daya genetik (SDG) berperan penting dalam perakitan
varietas unggul baru dalam usaha peningkatan produksi dan kualitas gandum
nasional. Pengelolaan SDG yang baik akan mempermudah dan mengefektifkan
kegiatan pemuliaan dalam merakit varietas unggul baru. Sumarno dan Zuraida,
(2004) mengemukakan bahwa semakin banyak koleksi plasma nutfah yang
dimiliki semakin besar peluang untuk mendapatkan sumber gen unggul yang
akan dirakit menjadi varietas unggul baru. Poehlman et al. (1995) dan Richards
(1997) melaporkan bahwa metode yang umum dilakukan dalam peningkatan
keragaman genetik tanaman adalah introduksi, seleksi, hibridisasi, bioteknologi,
dan mutasi.
Di negara kita perbaikan genetik gandum dilakukan melalui program
introduksi galur-galur elit dari berbagai negara/lembaga internasional seperti
CIMMYT, India, Turki, dan Slovakia (Azrai 2012). negara kita hampir tidak memliki
plasma nutfah gandum karena tanaman ini bukan tanaman asli negara kita . Salah
satu usaha untuk mendapatkan materi sumber daya genetik gandum adalah
melakukan introduksi kemudian dilanjutkan dengan persilangan dan seleksi
serta uji adaptasi di berbagai daerah. Tanaman introduksi yang memiliki daya
adaptasi baik, berproduksi tinggi, dan memiliki sifat unggul lainnya seperti tahan
terhadap hama dan penyakit dapat dinjurkan dilepas menjadi varietas unggul
baru.
Pada tahun 1978 Kementerian Pertanian negara kita membentuk tim untuk
uji adaptasi gandum introduksi dari CIMMYT di Kabanjahe, Sumatera Utara.
Hasil yang diperoleh dari uji pendahuluan galur gandum ini mencapai 4 t/
ha. Namun pengembangan uji adaptasi ini tidak terdata dan tidak berlanjut
(Ditjen Bina Produksi Tanaman Pangan 2001).
Pada periode 1980-1992 program perakitan varietas gandum
dikoordinasikan oleh Puslitbang Tanaman Pangan dengan melibatkan Balai
Penelitian Tanaman Pangan (Balittan) Bogor, Balittan Sukarami, dan Balittan
Sukamandi. Uji adaptasi galur gandum untuk dataran menengah pertama kali
dilakukan pada tahun 1981/1982 dengan 26 kombinasi persilangan pada wilayah
dengan ketinggian 900 m dpl dan menghasilkan dua galur asal Meksiko, 10
galur asal Thailand, enam galur dari negara kita , dan dua galur dari Jepang dengan
rata-rata hasil 1,9-4,3 t/ha (Azwar et al. 1988). Pada era 1980-an, uji adaptasi
plasma nutfah gandum terus dilakukan melalui introduksi genotipe yang sesuai
untuk wilayah tropis.
Pada tahun 1986, penelitian gandum dilanjutkan secara lebih luas yang
terfokus pada ketahanan terhadap penyakit karat (Puccinia striiformis). Penyakit
karat adalah salah satu penyakit tanaman gandum terpenting, khususnya di
daerah tropis dengan suhu dan kelembaban yang tinggi. Galur mutan gandum
diuji pada dataran tinggi (800-1.200 m dpl) di Cipanas, Jawa Barat, pada tahun
1992-1994. Beberapa galur mutan ini tahan terhadap penyakit, memiliki kualitas
tepung yang baik, dan hasil biji yang relatif tinggi (Soeranto 1997). Penelitian
gandum sempat terhenti pada tahun 1995, tetapi benih galur-galur mutan yang
telah dihasilkan masih tetap tersimpan dalam koleksi plasma nutfah gandum di
PATIR-BATAN.
Pada awal tahun 2000an dilakukan introduksi dan uji evaluasi terhadap 47
galur gandum di dataran tinggi Malino, Sulawesi Selatan (1.500 m dpl), dataran
sedang Bantaeng, Sulawesi Selatan (800 m dpl), dan dataran rendah Malang,
Jawa Timur (325 m dpl). Dari 47 galur yang dievaluasi, galur terbaik mampu
menghasilkan 5,05 t/ha di Bantaeng dan 0,37 t/ha di Malang. Galur yang
memberikan hasil yang baik di ketiga lokasi adalah KAUZ/ WEAVER masing
masing 5,79 t/ha di Malino, 1,75 t/ha di Bantaeng, dan 0,56 t/ha di Jambegede.
Masalah yang dihadapi di dataran sedang dan rendah adalah penyakit busuk
akar (Sclerotium sp). Pengujian di dataran sedang diperoleh satu galur yang
hasilnya lebih tinggi dari varietas Nias, yaitu BAW898, mencapai 2,5 t/ha, 49% di
atas hasil varietas Nias. Hasil galur ini di Malino 3,28 t/ha (Balitsereal 2006).
Selama periode 2002-2007 PATIR-BATAN terlibat dalam penelitian gandum
regional yang disponsori oleh IAEA melalui Regional Cooperation Agreement
(RCA), dengan negara peserta Tiongkok, Filipina, India, negara kita , Korea,
Malaysia, Pakistan, Sri Langka, Thailand, dan Vietnam. Dari kerja sama ini,
negara kita mendapatkan benih gandum dari IAEA yang bersumber dari Tiongkok
dan Pakistan (Tabel 2).
Pada tahun 2009 dilakukan uji adaptasi galur/varietas di Merauke Papua,
hasil yang diperoleh berkisar antara 1,27-2,37 t/ha (Tabel 3). Hasil tertinggi
diperoleh dari varietas OASIS/SKAUZ//4*BCN, yaitu 2,37 t/ha, lebih tinggi
dibanding varietas Selayar, Nias, dan Dewata yang masing-masing hanya 1,91,
1,62, dan 1,30 t/ha. Hasil yang diperoleh kemungkinan akan meningkat lagi jika
waktu berbunga bertepatan dengan suhu dingin yang berhembus dari Australia
pada akhir bulan Juni sampai pertengahan Agustus, sehingga gandum harus
ditanam pada awal Juni (Balitsereal 2010).
Beberapa galur gandum hasil perbaikan asal CIMMYT adaptif pada dataran
rendah dengan ketinggian 400 m dpl. (Bogor) yaitu OASIS/SKAUS//4* dan
HP1744 dengan potensi hasil masing-masing 2,37 t/ha, dan 2,80 t/ha, rata-rata
1,76 t/ha dan 1,96 t/ha. Selanjutnya galur perbaikan asal Turki Yitu BASRIBEY
mempunyai potensi hasil 2,73 t/ha dengan rata-rata 2,05 t/ha (Balitsereal 2010).
Pada tahun 2012-2013 dilakukan uji multilokasi genotipe yang adaptif dataran
menengah-rendah tropis, bekerja sama dengan Universitas Andalas. Terdapat
empat galur dengan adaptasi cukup baik pada dataran menengah yaitu
ASTREB*2/cbrd, aASTEB*2/NING/MAI9558, H-20, dan SO-3 (Slovakia). Pemuliaan
mutasi bekerja sama dengan BATAN menghasilkan sembilan mutan galur yang
kemudian dilakukan uji multilokasi di dataran tinggi dengan hasil biji 0,5-5 t/ha
(Azrai et al. 2014).
Dalam program pemuliaan, semakin banyak koleksi plasma nutfah yang
dimiliki, semakin besar peluang untuk mendapatkan sumber gen unggul yang
akan dirakit menjadi varietas unggul. Introduksi plasma nutfah yang disertai uji
adaptasi berperan dalam pembentukan varietas unggul gandum.
VARIETAS UNGGUL GANDUM YANG DILEPAS DI negara kita
Program penelitian gandum di negara kita dimulai pada tahun 1969, namun
pengelolaannya belum intensif. Pada tahun 1985 penelitian evaluasi galur
gandum introduksi dan seleksi populasi bersegregasi telah diinisiasi (Kusmana
dan Subandi 1985, Gayatri et al. 1989, dan Dasmal et al. 1995). Uji seleksi dan
adaptasi galur gandum pada dataran tinggi kemudian menghasilkan dua varietas
gandum yang dilepas oleh Kementerian Pertanian pada tahun 1993. Kedua
varietas ini masing-masing diberi nama Timor dan Nias. Timor adalah
varietas introduksi asal India dari tetua galur Punjab-81, sedangkan Nias berasal
dari galur Thai-88 yang diintroduksi dari Thailand. Kedua varietas telah melalui
uji adaptasi di Sumatera Barat, Jawa Barat, dan Jawa Timur pada daerah dengan
ketinggian 900 m dpl. dengan rata-rata hasil 2 t/ha, dan umur panen 85 dan 90
hari (Puslitbangtan, 1996).
Pada tahun 2001, Departemen Pertanian telah merintis pengembangan
gandum melalui uji demo tanam di NTT, NTB, Sulsel, Jatim, Jateng, dan Sumbar.
Pengembangan gandum juga dilakukan oleh Badan Litbang Pertanian melalui
uji multilokasi gandum dari India dan CIMMYT (International Maize and Wheat
Improvement Center) oleh beberapa lembaga penelitian dan perguruan tinggi
pada tahun 2003. Hasil uji adaptasi kemudian menghasilkan dua varietas gandum
yang sesuai untuk wilayah dataran tinggi/suhu rendah di negara kita , yaitu varietas
Selayar dan Dewata yang dilepas pada akhir tahun 2003. Hasil varietas Selayar
dan Dewata hampir sama, rata-rata 2,95 dan 2,96 t/ha. Umur panen varietas
Selayar agak dalam yaitu 125 hari, sedangkan varietas Dewata agak genjah, 82
hari (Zubachtirodin 2005).
Pengembangan gandum pada tahun 2004 dilakukan oleh Ditjen Bina
Produksi Tanaman Pangan Departemen Pertanian melalui gerakan “Gandum
Berkibar” menggunakan varietas Dewata, Selayar, Nias, dan Timor seluas 150
ha. Selanjutnya pada tahun 2005 pengembangan gandum diperluas menjadi
250 ha. Namun sejak tahun 2006, program Gandum Berkibar tidak berlanjut
sehingga areal pertanaman menurun setiap tahun (Welirang, 2015).
Dalam usaha percepatan pelepasan varietas unggul baru gandum yang
adaptif pada dataran rendah maka pada tahun 2009 Badan Litbang Pertanian
merintis konsorsium penelitian gandum dengan melibatkan beberapa institusi,
antara lain Balai Penelitian Tanaman Serealia, Balai Besar Penelitian dan
Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian), perguruan
tinggi (IPB dan UKSW), dan PATIR-BATAN. Penelitian konsorsium diarahkan pada
pembentukan varietas gandum tropis unggul melalui kegiatan konvensional
(hibridisasi dan seleksi antarfamili), dan pemuliaan non-konvensional (irradiasi,
kultur jaringan dan somaklonat, serta transgenik) (Azrai et al. 2010).
Pada tahun 2010 pemerintah negara kita melalui Kementerian Perekonomian
dan Universitas Andalas merintis kerja sama dengan pemerintah Slovakia untuk
pengembangan gandum tropis di negara kita . Uji adapatasi kultivar gandum
introduksi dari Republik Slovakia dilaksanakan di sembilan lokasi di Sumatera
Barat pada tahun 2011. Pada tahun 2012, penelitian dan pengembangan gandum
lebih diperluas di Provinsi NAD, Bengkulu, Jawa Barat, Jawa Tengah, Jawa Timur,
dan Sulawesi Selatan dengan melibatkan berbagai perguruaan tinggi dan
institusi penelitian setempat. Kegiatan pengembangan diarahkan untuk
mendapatkan genotipe gandum yang adaptif pada kondisi tropis serta
beradaptasi pada dataran menengah (Azrai et al. 2013).
Melalui kerja sama konsorsium, pada tahun 2013 telah dilepas tiga varietas
unggul gandum yaitu varietas Guri-1 dan Guri-2 yang dihasilkan oleh Badan
Litbang Pertanian dan Ganesha yang dihasilkan oleh BATAN. Guri adalah
singkatan dari Gandum untuk Rakyat negara kita . Varietas Guri-1 merupakan
hasil persilangan galur KAUZ*2//SAP/MON/3/KAUZ CRG969-2Y-010M-OY-OHTY
yang diintroduksi dari CIMMYT pada tahun 2001. Varietas ini tahan terhadap
penyakit karat dan hawar daun serta beradaptasi baik pada daerah dengan
ketinggian > 1.000 m dpl. Umur panen varietas Guri-1 agak dalam, yaitu 134 hari
dengan rata-rata hasil 5,8 t/ha. Varietas Guri 2 juga diintroduksi dari CIMMYT
pada tahun 2001 yang merupakan hasil persilangan galur CAZO/KAUZ//
KAUZCMBW90Y3284-OTOPM-14Y-010M-010Y-6M-015Y OY-OHTY. Umur panen
varietas ini juga agak dalam, yaitu 133 hari dengan rata-rata hasil 5,6 t/ha. Varietas
Guri-2 tahan terhadap penyakit karat dan agak toleran penyakit hawar daun
serta beradaptasi baik pada daerah dengan ketinggian > 1.000 m dpl (Aqil dan
Talanca 2014).
Varietas Ganesha merupakan hasil radiasi nuklir yang dilakukan oleh BATAN
yang produktivitasnya mencapai 5-6 t/ha, lebih tinggi dibanding varietas yang ada
sebelumnya seperti Dewata atau Nias yang hanya 3-4 t/ha. Ganesha telah diuji
pengembangannya di 10 lokasi di Jawa Timur, Sumatera Utara, dan Sulawesi
Selatan serta dilepas oleh Kementerian Pertanian pada tahun 2013. Keunggulan
lain yang dimiliki varietas Ganesha adalah tahan terhadap penyakit karat daun
dan kadari gluten tinggi sehingga cocok untuk industri roti dan mie instan. Varietas
Guri-1, Guri-2 dan Ganesha merupakan varietas yang sesuai dikembangkan di
wilayah dengan ketinggian > 1.000 m dpl (Aqil dan Talanca 2014).
Pada tahun 2014, Badan Litbang Pertanian melepas gandum untuk dataran
menengah yang diberi nama varietas GURI-3 Agritan, GURI-4 Agritan dan GURI-
5 Agritan. GURI-3 Agritan merupakan galur introduksi dari CIMMYT yang dibentuk
dan diseleksi sebagai spring wheat suhu tinggi. Galur ini beradaptasi baik pada
lingkungan tropis negara kita dengan rata-rata hasil 3,5 t/ha, lebih unggul
dibandingkan dengan varietas Nias dan Selayar.
Varietas GURI-4 Agritan juga diintroduksi dari CIMMYT yang dibentuk dan
diseleksi pada lingkungan High Rainfall Wheat (HRWYT), sesuai untuk curah
hujan tinggi. Varietas ini beradaptasi baik pada lingkungan subtropis negara kita
dengan rata-rata hasil 3,8 t/ha, lebih unggul dibandingkan dengan varietas Nias
dan Selayar. Varietas Guri-4 Agritan juga memiliki keunggulan karakter lain
dibandingkan dengan kedua varietas pembanding, yaitu jumlah malai/m2
,
panjang malai, jumlah spiklet/malai, jumlah biji/malai dan bobot biji/plot. Selain
itu, varietas ini juga memiliki tingkat infeksi penyakit hawar daun yang lebih
rendah (Aqil dan Talanca 2014).
GURI-5 Agritan merupakan galur H-20 yang diseleksi dari tipe simpang varietas
Dewata. Rata-rata hasil varietas ini 3,4 t/ha, lebih unggul dari varietas Nias, dan
sebanding dengan varietas Selayar. Keunggulan lain yang dimiliki varietas ini
dibandingkan dengan kedua varietas pembanding adalah pada jumlah malai/
m2
, panjang malai, jumlah spiklet/malai, dan jumlah biji/malai.
sifat fenotifik varietas unggul gandum yang telah dilepas pada
periode 1993-2014 dapat dilihat pada Tabel 4. Komposisi nutrisi varietas unggul
gandum yang dilepas pada periode 1993-2013 disajikan pada Tabel 5.
Gandum termasuk salah satu komoditas serealia yang mempunyai nilai gizi
yang tinggi. Pada biji gandum terkandung 60-80% karbohidrat, 8-15% protein,
lemak 1,5-2%, mineral dan sejumlah vitamin. Brooker et al (1992) mengemukakan
bahwa kandungan protein gandum berkisat 10.6% sedangkan padi
mengandung 7.3%. lebih tinggi dibandingkan dengan nasi yang hanya 2%.
Pengelolaan benih yang baik merupakan salah satu faktor penentu dalam
peningkatan produksi komoditas pangan. Permasalahan di lapangan
diantaranya belum terpenuhinya prinsip enam tepat di bidang perbenihan
yaitu tepat varietas, tepat jumlah, tepat mutu, tepat lokasi, tepat
waktu, dan tepat harga.
bahwa benih yang sehat dan
bermutu mempunyai kontribusi yang nyata terhadap penampilan fenotifik dan
komponen hasil tanaman. Terdapat tiga kriteria mutu benih yang perlu dipenuhi:
(a) mutu genetik, yaitu mutu benih berdasarkan identitas genetik yang telah
ditetapkan oleh pemulia dan tingkat kemurniannya, identitas benih tidak hanya
ditentukan oleh tampilan benih, tapi juga oleh fenotipe tanaman; (b) mutu
fisiologis, yaitu mutu benih berdasarkan daya kecambah dan ketahanan simpan
benih; dan (c) mutu fisik yang ditentukan oleh tingkat kebersihan, keseragaman
biji dari segi ukuran maupun bobotnya
Dalam sistem perbenihan gandum di negara kita , Balai Penelitian Tanaman
Serealia (Balitsereal) diberikan kewenangan untuk melakukan program
pemuliaan/pembentukan varietas unggul gandum termasuk menyediakan benih
sumber, khususnya benih kelas BS (breeder seed) dan FS (Foundation Seed).
Selanjutnya benih di kirim ke Dinas Pertanian Provinsi di bawah koordinasi
Direktorat Jenderal Tanaman Pangan, untuk diperbanyak menjadi benih klas SS
(Stock seed) di BBI/BBU. Namun saat ini, peran Balai Benih, khususnya dalam
penyediaan benih gandum sangat terbatas. Pemerintah juga belum memberikan
prioritas pada program perluasan areal tanam gandum.
Hingga periode 2010-2014, minat untuk mengembangkan komoditas
gandum masih minim. Hal ini terlihat dari kecilnya permintaan benih sumber
oleh mitra kerja sama, walaupun Balitsereal telah menyiapkan benih sumber
dalam jumlah besar setiap tahunnya. Penyebaran benih selama periode 2010-
2014 hanya 3.731 kg atau rata-rata 932 kg setiap tahun dengan wilayah
penyebaran meliputi Sumbar, Bengkulu, Jatim, NTB, NTT, DKI Jakarta, Jabar,
Banten, Sulsel dan Papua. Selain itu, benih kelas BS yang disebarkan hanya
sebagian kecil yang diperbanyak menjadi benih kelas di bawahnya.
Salah satu tantangan pengembangan gandum saat ini adalah penyediaan
varietas unggul yang sesuai dikembangkan pada daerah dengan ketinggian
menengah (< 800 m dpl) dan dataran rendah. Pemuliaan gandum yang adaptif
dataran menengah dan rendah memerlukan sentuhan bioteknologi dan
rekayasa genetik yang diharapkan menjadi terobosan dalam menghasilkan
varietas unggul gandum tropis yang dapat dikembangkan di dataran rendahsedang di negara kita .
Gandum merupakan komoditas pangan penting dunia dengan produksi 624
juta ton pada tahun 2005 (FAO 2006). Komoditas ini adalah sumber utama
karbohidrat sehingga penelitian peningkatan produksi gandum diusaha kan
melalui teknik bioteknologi. Ke depan, permintaan sereal diperkirakan tumbuh
sebesar 50% seiring dengan meningkatnya kebutuhan (Reynolds and Borlaug
2006). Di Eropa, sejak tahun 1950-an, hasil panen gandum meningkat rata-rata
0,1 t/ha, yang merupakan dampak dari perbaikan teknologi budi daya maupun
perakitan dan pengembangan varietas baru.
Genetika gandum lebih rumit dibandingkan dengan sebagian besar spesies
domestikasi lainnya karena tergolong allopolyploid, mengandung tiga genom
tetua yang berbeda (kode A, B dan D), masing-masing berisi tujuh pasang
kromosom homolog (Kumar and Singh 2010, Hussain et al. 2010). Oleh karena
itu jumlah kromosom dalam genom diploid (2n) adalah 42, atau juga disebut
sebagai 6x, karena masing-masing genom tetua memiliki tujuh kromosom.
Beberapa spesies gandum diploid, seperti T. monococcum, mempunyai dua set
kromosom, namun banyak juga yang polyploids stabil dengan empat set
kromosom atau tetraploid, misalnya gandum durum dengan enam set
kromosom (hexaploid).
Dalam program pemuliaan gandum secara konvensional, ratusan ribu galur
dibutuhkan untuk menghasilkan varietas baru setiap beberapa tahun. Biaya
yang mahal adalah pada uji multilokasi dan evaluasi untuk beberapa sifat,
terutama kualitas hasil biji dan stabilitas hasil. Bioteknologi diharapkan dapat
memainkan peranan utama dalam meningkatkan produktivitas gandum
dengan meningkatkan toleransi atau ketahanan terhadap cekaman biotik dan
abiotik, meningkatkan efisiensi pemakaian air dan nitrogen, serta menyediakan
varietas spesifik untuk industri hilir.
negara kita bukan penghasil gandum sehingga ketergantungan terhadap
tepung terigu cukup tinggi yang membutuhkan devisa yang cukup besar. Salah
satu usaha untuk mengembangkan gandum di negara kita yang beriklim tropis
adalah merakit varietas toleran suhu tinggi. Pengembangan tanaman gandum
di negara kita relatif lambat karena selain bersaing dengan tanaman pangan
utama seperti padi, jagung, kedelai, kondisi lingkungan tropis khususnya suhu
tinggi kurang mendukung pertumbuhan dan produksi gandum. Varietas
gandum dari daerah subtropis pada umumnya tidak dapat berproduksi dengan
baik di negara kita . Kalau pun dapat tumbuh dan berproduksi, tanaman gandum
introduksi membutuhkan adaptasi yang cukup lama. Varietas gandum yang
dilepas di negara kita umumnya sesuai untuk lahan dataran tinggi atau kondisi
suhu dingin. Masalah lain adalah koleksi plasma nutfah gandum introduksi
memiliki variabilitas genetik yang sempit karena sifatnya yang menyerbuk sendiri,
sehingga peluang keberhasilan rekombinasi untuk perbaikan varietas relatif
kecil. Hasil karakterisasi 44 aksesi koleksi plasma nutfah gandum menggunakan
marka SSR menunjukkan variabilitas genetik relatif sempit (Pabendon et al.
2011). Pada tahun 2014 analisis keragaman genetik dilanjutkan dengan
menambah koleksi plasma nutfah baru menjadi 147 aksesi menggunakan 43
marka SSR. Hasilnya juga serupa, yaitu memiliki variabilitas genetik yang
cenderung sempit yang ditunjukkan oleh tingkat polimorfisme 0,59 dan ratarata 3 alel per lokus SSR. Hasil karakterisasi molekuler progeny S3 hasil
persilangan konvergen menggunakan marka SSR menunjukkan adanya
peningkatan variabilitas genetik pada populasi plasma nutfah gandum dan
diperoleh 22 kandidat pasangan genotipe yang memiliki peluang heterosis
(Syahruddin et al. 2015).
Berdasarkan hal ini maka program perakitan varietas unggul gandum
di negara kita diarahkan untuk mendapatkan varietas toleran suhu tinggi atau
gandum tropis guna meningkatkan kemampuan adatasi dan potensi hasil.
Dalam hal ini dibutuhkan proses seleksi yang sangat teliti dalam memilih
rekombinan potensial untuk meningkatkan variabilitas genetik. Teknologi
berbasis marka molekuler berperan penting untuk mengetahui kondisi
variabilitas genetik plasma nutfah yang dimiliki. Pemilihan rekombinan potensial
didasarkan pada nilai jarak genetik untuk meningkatkan variabilitas genetik,
maupun mengidentifikasi aksesi yang terpaut dengan gen toleran cekaman
suhu tinggi yang bersifat kuntitatif atau dikendalikan oleh banyak gen.
PERANAN REKOMBINASI DALAM PERAKITAN
VARIETAS GANDUM
Meskipun teknologi rekombinasi berperan penting dalam pemuliaan genom,
pemahaman mengenai rekombinasi pada gandum masih terbatas.
Perkembangan peta genetik gandum dan hasil penelitian dari berbagai program
aplikasi marka telah menegaskan kurangnya keseragaman laju rekombinasi,
terutama di sepanjang kromosom gandum. Peta yang menunjukkan hubungan
antara jarak fisik dan genetik pada barley telah tersedia (Künzel et al. 2000) dan
penelitian terbaru menganalisis distribusi kejadian rekombinasi di sepanjang
kromosom gandum. Akhunov et al. (2003) menggambarkan hubungan terbalik
antara synteny dan gradien rekombinasi sepanjang kromosom gandum. Hal
ini menunjukkan bahwa tingkat synteny menurun seiring dengan semakin
panjangnya jarak sumbu sentromer-telomer. Tidak mengherankan terjadinya
kehilangan synteny lebih cepat di daerah kromosom homoeologous
rekombinasi tinggi dibandingkan dengan daerah rekombinasi rendah. Hal ini
konsisten dengan hasil penelitian Gill et al. (1993) yang menunjukkan daerah
distal kromosom gandum diasosiasikan dengan daerah kaya gen.
Selain variasi tingkat rekombinasi yang terjadi di sepanjang kromosom
gandum dan barley, ada juga bukti bahwa tingkat rekombinasi akan sangat
bervariasi antarpersilangan. Hal ini dapat dilihat dari perbandingan antara hasil
pemetaan populasi yang berbeda (Chalmers et al. 2001), dan bisa menjadi sangat
ekstrim ketika yang diamati adalah perilaku kromosom asing atau bahkan pada
landrace (Paull et al. 1994). Dalam beberapa kasus, blok linkage yang
menggunakan beberapa persilangan dengan jumlah populasi besar kurang
baik karena rekombinasi bisa kacau (Paull et al. 1994). Sebagai alternatif, galurgalur gandum dengan aktivitas Ph1 atau Ph2 yang rendah dapat digunakan
untuk mempercepat pecahnya blok kromosom sehingga dapat bermanfaat
dalam mengintrogresi kromatin asing ke dalam gandum (Koebner and Shepherd
1985, Riley et al. 1966). Pendekatan lain adalah mengembangkan galur-galur
gandum dengan melakukan modifikasi melalui rekombinasi tingkat tinggi.
Secara teoritis, hal ini dapat dicapai dengan mengover-ekspresikan gen tertentu
yang terlibat dalam rekombinasi atau mematikan gen yang bertanggung jawab
untuk memperlambat rekombinasi, seperti gen yang mengkode enzim
perbaikan DNA (Langridge et al. 2000). Jika perilaku kromosom pada gandum
telah dipahami secara lebih rinci, maka alternatif pilihan akan lebih banyak
dalam mengelola dan mengidentifikasi proses-proses penting saat terjadinya
rekombinasi.
PEMULIAAN GANDUM BERBASIS PENANDA MOLEKULER
Dari sudut pandang evolusi, gandum adalah polyploid muda dan mempunyai
konfigurasi genetik yang merupakan contoh klasik hubungan kekerabatan
tanaman serealia. Kemiripan genom gandum dengan padi dan jagung
membuka jalan untuk mengembangkan varietas gandum yang lebih unggul.
Banyak varietas unggul gandum toleran cekaman telah dikembangkan
berdasarkan informasi hasil penelitian filogenetik (Kumar and Sharma 2011).
Penanda molekuler dapat membantu data morfologi yang juga relatif mahal
dan sering kurang akurat karena banyak dipengaruhi oleh lingkungan. Penanda
molekuler sudah banyak digunakan untuk melacak lokus dan daerah genom
dalam program pemuliaan gandum. Sebagai contoh di Australia, sejumlah
varietas telah dilepas dengan menggunakan alat bantu penanda molekuler pada
tahap -tahap tertentu selama proses pemuliaan. Letak beberapa lokus utama dapat
dikenal melalui gen penyandi ketahanan terhadap penyakit, toleransi terhadap
cekaman biotik, serta karakter kuantitas dan kualitas lainnya. Terdapat juga
beberapa perbaikan yang signifikan dalam teknologi skrining marka yang
mampu mengurangi biaya karena meningkatnya kehandalan skrining berbasis
marka genotipik. Efisiensi pemakaian marka dipengaruhi oleh jarak marka
terhadap lokus target dan keberhasilan marka dalam mendeteksi polimorfisme
genotipe yang digunakan dalam program pemuliaan
Prasyarat pertama untuk analisis genom adalah pengembangan penanda
molekuler dan peta keterpautan. Peta pertama gandum yang diterbitkan pada
tahun tahun 1995 menggunakan marka RFLP merupakan kontribusi besar bagi
usaha pemetaan yang telah mengembangkan 2.200 penanda SSR. Informasi
pemetaan telah ditingkatkan melalui pengembangan peta komposit dan peta
ini sekarang diselaraskan dengan peta fisik melalui pemetaan bin SSR yang
terseleksi pada galur-galur delesi (Gandon and Crépieux 2008).
Baru-baru ini, pustaka BAC (Bacterial Artificial Chromosome) menawarkan
cakupan genome maupun kromosom spesifisitas (Safar et al. 2004), merupakan
alat ampuh untuk peta berbasis kloning. Contoh terbaru dari peta berbasis
kloning adalah isolasi lokus ph1 (Griffiths et al. 2006), yang mencegah kromosom
berpasangan selama proses meiosis baik, pada gandum durum maupun
gandum roti.
International Triticeae EST (Expressed Sequence Tags) Cooperative (ITEC)
telah merilis 853.401 marka EST untuk gandum yang semuanya tersedia untuk
umum. Sebuah bin kromosom yang terdiri atas 16.000 lokus EST juga telah
diterbitkan (Qi 2004), memberikan peluang bagi pengembangan marka SNP
melalui pemetaan kepadatan atau kejenuhan tinggi. Namun, pengembangan
SNP pada gandum lebih sulit dibandingkan dengan jenis tanaman lainnya
karena sifat hexaploid dari genom, yang memicu kesulitan dalam
merancang genom primer PCR spesifik (Gandon and Crépieux 2008).
Program genom tanaman NSF adalah yang pertama dalam menggunakan
urutan EST untuk pengembangan SNP dan telah diinformasikan sejumlah 17.174
primer, yang dilaporkan sebagai polimorfik sebanyak 1.102. Alat bantu genomik
ini telah digunakan dalam berbagai aplikasi yang memicu pentingnya
pemetaan gen QTL dan agronomis, serta peta berbasis kloning gen pada
beberapa lokus penting. Pada gandum, lebih dari 100 gen telah dipetakan,
terutama untuk penyakit, nematoda atau ketahanan terhadap serangga (Feuillet
& Keller 2005). Saat ini, informasi marka telah tersedia yang dapat dimanfaatkan
untuk meningkatkan karakter penting dalam plasma nutfah, seperti karakterkarakter penting dari materi genetik eksotis yang memungkinkan untuk
diintrogresi secara cepat melalui MAS (Marker Assisted Selection), antara lain (i)
ketahanan terhadap penyakit brown rust dan yellow rust (Lr9, Lr10, Lr19, Lr24,
Lr37/Yr17/Sr38, Yr15, Lr34/Yr18, Lr46/Yr29); (ii) ketahanan terhadap eye spot
(Pch1); (iii) ketahanan terhadap powdery mildew (PM3, Pm4b, Pm8/Pm17,
MlRe); (iv) ketahanan terhadap Septoria tritici (Stb6); (v) ketahanan terhadap
Fusarium (QTL yang berasal dari Sumai3 yaitu Qfhs.ndsu-3BS, Frontana, dan
sumber-sumber lain dari Eropa); (vi) gen yang terlibat dalam pertumbuhan
tanaman (RhtB1b (Rht1), RhtD1b (Rht2), Rht8, Vrn1); dan (vii) karakter terkait
kualitas (hasil PCR glutenin berat molekul tinggi pada alel tertentu, puroindolins,
dan terigu lilin) (Gandon and Crépieux 2008).
Jika konsep pengembangan idiotipe berbasis genetik sebagai dasar dalam
merancang strategi persilangan dan seleksi untuk membangun idiotipe baru
untuk beberapa kondisi dan pada sejumlah kasus, maka hal ini akan menjadi
salah satu pendekatan. Sebagai contoh, informasi yang dibutuhkan untuk
mengembangkan dan menerapkan strategi dengan menggunakan data genetika
yang dihasilkan dari empat populasi haploid ganda hasil pemetaan dengan
melibatkan hasil analisis kemajuan genetik selama beberapa tahun. Pada saat
strategi dimulai, hampir semua informasi pemetaan awal telah tersedia. Untuk
aplikasi selanjutnya, berdasarkan pendekatan ini, dapat melibatkan materi
dengan latar belakang genetik yang berbeda atau mengintegrasikan yang
berbeda, dan berpotensi tumpang tindih dengan set lokus atau keterpautan
blok.
Strategi karakter ideotipe hanya salah satu dari banyak pendekatan
pemuliaan seluruh genom yang berpeluang diterapkan pada perbaikan
gandum. Contoh aplikasi yang sedang dilakukan di Australia yaitu usaha untuk
menggabungkan alel yang diinginkan pada beberapa lokus gandum toleran
genangan dari sejumlah koleksi galur-galur Eropa, Jepang dan Kanada, sehingga
menjadi latar belakang genetik gandum Australia yang unggul dan mampu
beradaptasi dengan baik (Vassos et al. 2003). Selain itu berusaha untuk
memperbaiki beberapa kekurangan dari genotipe gandum unggul yang
dihasilkan (Kuchel et al. 2003). Dalam aplikasi ini diperoleh informasi detail dari
kontrol genetik dan lokasi dari gen target serta informasi fenotipik galur-galur
elit yang tersedia. Dari sejumlah strategi yang mulai diaplikasikan, akumulasi
informasi yang dibutuhkan merupakan proses yang memakan waktu dan
mahal.
Kemajuan metode skrining marker telah membantu mengatasi kelemahan
ini sehingga menciptakan lebih banyak peluang terhadap strategi ini .
Hal terpenting adalah pergeseran ke studi asosiasi genetika pada gandum mulai
memberikan pandangan mengenai inti dari pautan blok dan memahami struktur
haplotipe dari tanaman target. Informasi ini berperan penting pada generasi
berikutnya dari strategi pemuliaan seluruh genom.
Deteksi bobot molekul rendah gen HSP (heat shock protein) yang disintesis
dari T. durum dalam kaitannya dengan thermo-toleransi telah dilketahui. Respon
toleran panas genotipe T. aestivum yang berbeda untuk enzim seperti NRA dan
Peroksidase telah dibuktikan dapat menunjukkan thermo-toleransi. Secara
umum gen penyandi cekaman toleransi abiotik sangat kompleks sehingga sulit
dalam melakukan seleksi fenotipik. Pendekatan berbasis MAS (Marker Assisted
Selection) lebih efektif untuk kasus ini . Namun belum banyak informasi
mengenai pemanfaatan MAS secara rutin
Waktu pengisian biji telah digunakan sebagai salah satu parameter untuk
mengidentifikasi genotipe gandum toleran panas (Bhullar and Jenner 1985,
Yang et al. 2002, Mohammadi et al. 2008). Sadat et al. (2013) mengungkapkan
kegunaan penanda SSR dikaitkan dengan berbagai karakter yang berkaitan
dengan toleransi sifat panas yang telah digunakan sebagai parameter seperti
periode pengisian biji pada tanaman biji-bijian, HSI (Heat Susceptibility Index)/
bobot kernel malai utama, HSI/periode pengisian biji, dan HSI/bobot kernel
pada kondisi cekaman panas dengan menggunakan MAS untuk skrining 25
genotipe gandum roti toleran cekaman panas. Penelitian masih terbatas untuk
mengidentifikasi penanda genetik yang terkait dengan toleransi cekaman panas
pada tanaman yang berbeda. Berdasarkan hal ini maka yang perlu
dipahami terlebih dahulu adalah faktor genetik yang mempengaruhi toleransi
cekaman panas serta mengidentifikasi penanda diagnostik baru yang akan
digunakan dalam MAS, yang akan lebih memastikan hasil secara lebih cepat
pada kondisi lingkungan cekaman panas.
DASAR MOLEKULER GANDUM TOLERANSI
CEKAMAN SUHU TINGGI
Toleransi terhadap cekaman panas adalah fenomena yang kompleks dan
dikontrol oleh beberapa gen yang menginformasikan sejumlah perubahan
fisiologis dan biokimia dan tidak ada karakter tunggal menjelaskan mekanisme
toleransi panas. Informasi dasar molekuler dan genetik toleransi panas untuk
mengidentifikasi penanda molekuler akan meningkatkan efisiensi program
perbaikan gandum yang ditargetkan untuk mengembangkan kultivar toleran
panas.
Suhu tinggi mempersingkat durasi pengisian biji dan mengurangi waktu
untuk apoptosis dan waktu panen (Altenbach et al. 2003). Paparan suhu tinggi
(> 350
C) pada tahap akhir pertumbuhan merupakan masalah pada 40% daerah
pengembangan gandum pada lingkungan beriklim sedang. Beberapa
pendekatan berbasis pemuliaan telah diusulkan untuk karakter yang terkait
dengan hasil dan yang selalu menjadi tolok ukur adalah mengukur keberhasilan
genotipe pada lingkungan cekaman panas. Setiap kenaikan suhu di atas 15oC
menurunkan hasil 3% (Wardlaw et al. 1989). Bobot kernel yang dapat
dipertahankan secara optimum di bawah cekaman merupakan kriteria yang
baik untuk mengukur toleransi panas (Tyagi et al. 2003).
Ada dua pendekatan untuk memahami sifat-sifat kuantitatif dan kompleks,
yaitu melalui pendekatan genome-wide scanning dan kandidat gen. Genomewide scanning merupakan pendekatan dengan sumberdaya yang mahal dan
intensif yang menempatkan daerah kromosom dari lokus-lokus karakter
kuantitatif pada tingkat cM dengan bantuan penanda molekuler berdasarkan
desain percobaan berbasis populasi, yang biasanya mengandung sejumlah
besar gen putatif. Sebagai perbandingan, pendekatan kandidat gen adalah
metode yang lebih efektif dan ekonomis untuk mempelajari arsitektur genetik
dari sifat-sifat kompleks (Zhu and Zhao 2007). Heat shock protein (HSPs) berfungsi
sebagai molekul chaperone yang bertanggung jawab untuk protein folding,
perakitan, translokasi dan degradasi dalam banyak proses seluler, stabilisasi
protein dan membran, dan membantu mempertahankan protein refolding di
bawah kondisi cekaman, termasuk suhu tinggi (Wang et al. 2004).
Studi proteome menunjukkan kultivar gandum toleran panas memiliki
respon yang berbeda terhadap cekaman panas dibandingkan dengan kultivar
rentan dalam bentuk HSPs (Skylas et al. 2002). Profil protein setelah mengalami
stres panas mengungkapkan tidak hanya perbedaan kuantitatif dalam HSPs
secara individu tetapi juga beberapa HSPs unik ditemukan pada genotipe toleran
panas. Messenger RNA yang mengkode kelas utama HSPs bobot molekul rendah
(HSP16.9) terdeteksi pada genotipe gandum terkena suhu tinggi (Nguyen et al.
1994). Beberapa laporan menunjukkan bahwa berbagai jenis HSP disintesis
dari jaringan gandum menanggapi durasi dan jenis cekaman panas yang
berbeda (Zivy 1987, Weng and Nguyen 1992, Treglia et al. 1999, Rampino et al.
2009, Sharma-Natu et al. 2010, Xu et al. 2011). Sebagian besar studi tentang HSP
dalam kaitannya dengan cekaman panas didasarkan pada analisis ekspresi
HSP namun belum ditemukan literatur tentang HSP berbasis penanda dalam
program pemuliaan yang toleran cekaman panas pada gandum. Analisis ekspresi
juga membutuhkan keterampilan teknis yang tinggi dan tidak mungkin untuk
melakukan studi ekspresi dengan memisahkan populasi.
Dalam penelitian genetik tanaman, MAS menyediakan strategi untuk
mempercepat proses pemuliaan gandum. Polimorfisme nukleotida tunggal
(SNP) terdapat dalam jumlah yang hampir tak terbatas, dan beberapa perbedaan
urutan nukleotida antara individu memiliki potensi terpaut dengan fenotipe
yang dapat dikonversi menjadi penanda genetik untuk genotipe high-throughput
(Rafalski 2002). Informasi terkini menunjukkan belum ada laporan tentang SNP
di HSP terkait dengan thermotolerance. Dalam studi ini, telah dikembangkan
penanda SNP pada gen HSP16.9 gandum roti untuk mengidentifikasi genotipe
rentan dan toleran panas menggunakan PCR primer spesifik alel.
Ekspresi HSP adalah respon molekul yang paling banyak dipelajari di bawah
cekaman panas. HSP menyimpan protein dari hasil agregasi akibat panas
sehingga selama periode pemulihan dapat memfasilitasi protein kembali refolding (Hendrick and Hartl 1993, Scho¨ffl et al. 1998, Feder and Hofmann 1999,
Maestri et al. 2002). Ekspresi gen HSP merupakan respon awal terhadap
cekaman (Rampino et al. 2009). Bila terkena suhu tinggi (> 35o
C), sintesis protein
normal pada gandum berkurang, tetapi memproduksi HSP (Blumenthal et al.
1994).
Nguyen et al. (1994) mendeteksi RNA pembawa Hsp-HSP16.9 yang
mengkode bobot molekul rendah pada genotipe gandum yang ditanam pada
suhu 32-35oC. Pada studi lain, beberapa varietas gandum terkena suhu 3,2-
3,6oC lebih tinggi dari biasanya, HSP18 terakumulasi lebih tinggi pada saat
pembentukan biji pada varietas toleran panas dibandingkan varietas rentan
(Sharma-Natsu et al. 2010). Sumesh et al. (2008) juga mengamati kandungan
HSP 100 lebih tinggi pada suhu tinggi pada berbagai varietas yang relatif toleran.
Protein dehydrine merupakan bagian dari dua grup protein late embryo genesis
(LEA) yang berlimpah. Dehydrins membantu menstabilkan makro-molekul yang
disebabkan oleh kerusakan akibat panas (Brini et al. 2010). Pada gandum,
misalnya, protein DHN-5 membantu melindungi dan menstabilkan enzim kunci
untuk memulai metabolisme (Brini et al. 2010).
PERAKITAN VARIETAS GANDUM TROPIS
BERBASIS PENANDA MOLEKULER
Perakitan varietas gandum tropis (suhu tinggi) merupakan salah satu alternatif
dalam pengembangan gandum di negara kita . Aplikasi marka molekuler (SSR)
secara sederhana yang telah dilakukan selama beberapa tahun terakhir antara
lain (1) karakterisasi secara molekuler beberapa set koleksi plasma nutfah
gandum untuk mengetahui variabilitas genetik koleksi ini ; (2) menyeleksi
pasangan-pasangan rekombinan potensial berdasarkan estimasi nilai jarak
genetik (> 0,60), sebagai salah satu cara untuk meningkatkan variabilitas genetik;
(3) pembentukan populasi baru menggunakan metode persilangan konvergen
untuk meningkatkan variabilitas genetik berdasarkan pasangan rekombinan
potensial, kemudian progeny hasil persilangan dikarakterisasi kembali
menggunakan penanda SSR untuk mengetahui apakah terjadi peningkatan
veriabilitas genetik; (4) mengidentifikasi koleksi plasma nutfah gandum yang
mempunyai gen terpaut toleran suhu tinggi dan gen-gen ketahanan lainnya,
yaitu ketahanan terhadap penyakit karat daun menggunakan marka spesifik,
utamanya pada aksesi-aksesi yang berpeluang untuk meningkatkan variabilitas
genetik. Hasil analisis keragaman genetik 147 koleksi plasma nutfah gandum
yang dilakukan Andriani et al. (2015) menunjukkan nilai jarak genetik berkisar
antara 0,04-0,62. Dari total 147 aksesi yang dianalisis terdapat 10.732 rekombinan,
dan hanya 35 rekombinan yang potensial berdasarkan nilai jarak genetik >0,60
yang melibatkan 28 aksesi, berpeluang untuk meningkatkan variabilitas genetik.
Semua rekombinan yang berpeluang meningkatkan variabilitas genetik berada
pada klaster atau sub-klaster yang berbeda.
KEMAJUAN INFORMASI GENOMIK GANDUM
Dalam beberapa tahun terakhir, alat analisis skala genom telah diterapkan untuk
mempelajari perubahan global dalam ekspresi gen, proteome, dan metabolome
untuk memahami jalur metabolisme dan regulasi jaringan yang terlibat dalam
toleransi cekaman abiotik dan biotik (Nakashima et al. 2009, Hirayama and
Shinozaki 2010). Data sekuens pendek genom gandum telah dipublikasi dan
diperkirakan terdapat 94.000-96.000 gen yang mengatur dua-pertiga dari tiga
komponen genom (A, B dan D) dari gandum hexaploid (Brenchley et al. 2012).
Hal ini merupakan informasi penting yang dapat dimanfaatkan sebagai sumber
daya genom yang berharga untuk identifikasi gen, alel, dan daerah genom yang
dapat dimanfaatkan dalam merakit sejumlah varietas toleran. Selain itu, beberapa
fokus utama yang muncul ke permukaan seperti integrasi transkriptomik,
proteomik, metabolomik bertujuan guna mengembangkan sistem pendekatan
biologi untuk mengungkap mekanisme yang terlibat dalam toleransi cekaman
abiotik pada tanaman (Urano et al. 2010, Moreno-Risueno et al. 2010, Cramer et
al. 2011).
Studi tentang organisasi genom gandum menunjukkan lebih 85% dari total
gen gandum menempati kurang dari 10% daerah kromosom (Deepak and Gill
2004). Perkiraan sederhana berdasarkan keterangan urutan 11,1 Mb dari klon
BAC yang dipilih secara acak, dan dengan mempertimbangkan fakta bahwa
jumlah gen bervariasi sebanyak 32% ketika urutan yang sama dijelaskan oleh
peneliti yang berbeda, bahwa genom gandum mengandung gen protein
penyandi antara 164.000 - 334.000, termasuk pseudo gen (Devos et al. 1994).
Hasil pemetaan secara fisik menunjukkan gandum mengandung 3.025 lokus,
termasuk 252 gen yang ditandai sebagai karakter fenotipik dan 17 lokus
menunjukkan sifat kuantitatif (QTL). Terdapat 29% gen yang menempati
sebagian kecil genom gandum pada daerah padat gen (gen-rich region = GRR),
18% muncul sebagai gen mayor dan 30% sebagai minor gen. GRR bervariasi
dalam jumlah maupun kepadatan gen. Secara fisik, terdapat lima GRR terbesar
mencakup 3% dari genom yang mengandung 26% gen gandum. Perkiraan
ukuran GRR berkisar 3-71 Mb. Rekombinasi terutama banyak terjadi pada GRR.
Dari berbagai macam GRR bervariasi sekitar 128 kali lipat untuk kepadatan gen
dan 140 kali lipat untuk tingkat rekombinasi (Erayman et al. 2004).
Dalam beberapa tahun terakhir, alat analisis berbasis genomik telah
diterapkan untuk mempelajari perubahan global dalam ekspresi gen, proteome,
dan metabolome untuk memahami jalur metabolisme dan regulasi jaringan
yang terlibat dalam toleransi cekaman abiotik dan biotik (Nakashima et al. 2009,
Hirayama and Shinozaki 2010). Baru-baru ini data sekuens pendek genom
gandum telah diterbitkan yang diperkirakan antara 94.000-96.000 gen, yang
mengatur dua-pertiga dari tiga komponen genom (A, B dan D) gandum
hexaploid (Brenchley et al. 2012). Informasi berharga yang bersumber dari
genom ini bermanfaat untuk identifikasi gen, alel, dan daerah genom
untuk pengembangan varietas toleran. Selain itu, penekanan utama pada
integrasi transcriptomik, proteomik, metabolomik bertujuan untuk menciptakan
sistem pendekatan biologi untuk mengungkap mekanisme yang terlibat dalam
toleransi cekaman abiotik pada tanaman (Urano et al. 2010, Moreno-Risueno et
al. 2010, Cramer et al. 2011).
Transcriptomik. Cekaman abiotik merupakan karakter kompleks, sehingga
diprediksi banyak gen akan terlibat dalam berbagai respon fisiologis dan biokimia
cekaman abiotik pada tanaman. Oleh sebab itu, studi tentang profil ekspresi
gen secara komprehensif pada beberapa gen dapat memberikan informasi
tentang mekanisme cekaman abiotik pada tanaman. Di masa lalu, alat-alat seperti
mikroarray, substraksi pustaka, cDNA-AFLP, serial analysis of gene expression
(SAGE) dan hasil sekuensing transkriptome secara keseluruhan telah
teridentifikasi pada sejumlah besar gen tanaman yang terlibat dalam respon
cekaman abiotik dalam tanaman, termasuk gandum (Fowler and Thomashow
2002, Kreps et al. 2002, Seki et al. 2002, Wong et al. 2006). Qin et al. (2007)
mengungkapkan profil ekspresi gen dari genom secara komprehensif pada
benih genotipe gandum toleran panas ‘TAM107’ dan genotipe gandum ‘Spring
Chinese’ yang rentan cekaman panas dengan menggunakan microarray. Pola
perubahan ekspresi gen pada genotipe berbeda nyata dengan perlakuan panas
waktu singkat dan waktu yang berlangsung lama. Selain itu, genotipe kontras
menunjukkan karakter yang berbeda, baik up-regulation maupun downregulation, termasuk jalur sinyal HSPs, faktor transkripsi, fitohormon biosintesis/
signaling, kalsium, dan gula pada perlakuan panas yang singkat dan yang
berlangsung lama. Oleh karena itu, respon gandum terhadap cekaman panas
kemungkinan dimediasi melalui jalur sinyal transduksi yang melibatkan hormon
tanaman, kalsium, dan molekul gula seperti yang dilaporkan juga terjadi pada
spesies lain (Larkindaleet et al. 2005, Larkindale and Vierling 2008, Liu et al. 2003,
Calderwood et al. 2010). Analisis transkriptome yang mengacu pada hasil biji
dan perkembangan daun bendera pada gandum lebih relevan dalam
mengidentifikasi sejumlah karakter dan pathway untuk toleransi cekaman panas
pada gandum yang ditunjukkan oleh terjadinya penggulungan daun bendera
dan penurunan hasil yang signifikan dari gandum ini . Chauhan et al. (2011)
mengidentifikasi perbedaan expressed sequence tags (EST) gandum di bawah
cekaman panas dari pustaka cDNA subtraktif dari 3’ forward – 1’ reverse yang
dikonstruksi mulai dari tahap pembibitan sampai tahap pembungaan. Beberapa
EST ditemukan spesifik untuk cekaman panas, namun juga banyak terdeteksi
ekspresi yang menanggapi cekaman abiotik lain, sehingga diduga terjadi interaksi
dengan cekaman abiotik lainnya. Rampino et al. (2012) menganalisis efek
kombinasi toleransi cekaman panas dan kekeringan yang ditunjukkan oleh
terjadinya perubahan dalam ekspresi gen secara global pada daun bendera
gandum durum menggunakan cDNA-AFLP, dan ditemukan regulasi dari jumlah
gen yang lebih tinggi setelah perlakuan kombinasi cekaman dibandingkan
dengan perlakuan cekaman tunggal seperti yang terdeteksi pada spesies lain.
Pada beberapa EST baru (selain EST yang terlibat dalam dehydrins dan HSPs) di
bawah kondisi cekaman panas, kekeringan, atau cekaman gabungan juga
diidentifikasi. Berdasarkan hal ini jelas bahwa studi transcriptome telah
memberikan kontribusi yang besar dalam memahami cekaman panas pada
gandum.
Proteomik. Perubahan ekspresi gen tanaman selama pertumbuhan,
pengembangan dan paparan terhadap variasi lingkungan tercermin dari
perubahan enzim dan/atau protein pada berbagai tingkat dari jalur metabolik
(Hakeem et al. 2012). Hal ini menunjukkan pentingnya analisis proteome gandum
untuk memahami dasar molekuler toleransi cekaman panas pada beberapa
kultivar gandum. Bahkan, dengan ketersediaan teknik analisis proteome yang
sensitif dan akurat, proteomik telah muncul sebagai alat yang ampuh dalam
menemukan gen dan lintasan yang terlibat dalam respon cekaman abiotik pada
tanaman (Chen and Harmon 2006, Kosova et al. 2011). Protein/enzim dan jalur
metabolik kunci diidentifikasi dari galur-galur gandum toleran yang berpotensi
sebagai target dalam merakit varietas gandum toleran cekaman panas.
Majoul et al. (2004) menganalisis pengaruh cekaman panas pada proteome
gandum hexaploid menggunakan elektroforesis dua dimensi (2-DE) dan matrixassisted laser desorption/ionization-time of flight-mass spectrometry (MALDITOF-MS). Sebanyak 43 protein diferensial terekspresi di bawah cekaman panas,
terdiri atas enzim metabolisme karbohidrat, ATP synthase â-chain yang terkait
dengan empat protein penurun panas, heat shock protein, dan beberapa protein
pertahanan lainnya. Titik-titik yang terekspresi secara berbeda mewakili berbagai
kelompok protein termasuk HSPs, protein yang terlibat dalam glikolisis dan
metabolisme karbohidrat, serta cekaman yang berhubungan dengan protein
(Laino et al. 2010). Ekspresi HSPs ini tidak mengherankan karena dapat
melakukan beberapa fungsi strategis seperti mencegah denaturasi protein yang
ada atau misfolding protein yang baru disintesis (Vierling 1991, Timperio et al.
2008). Namun peran yang tepat dari sejumlah HSPs gandum pada kondisi
cekaman panas belum dipahami secara menyeluruh. Panas hasil induksi HSPs
pada gandum yang tergolong HSPs dengan bobot molekul tinggi seperti HSP70,
HSP90, sedangkan HSPs yang tergolong bobot molekul rendah seperti HSP26
(Laino et al. 2010). Sebagai contoh, HSP70 sangat jelas terkait dengan fungsi
akuisisi thermo-toleransi dan terlibat dalam pelipatan dan oligomerisasi protein
untuk mencegah agregasi ireversibel (Hendrick and Hartl 1993). Oleh karena
itu, selain HSPs dan metabolisme energi protein yang terkait, metabolisme enzim
karbohidrat yang terekspresi berbeda di bawah kondisi cekaman panas dapat
dipahami secara jelas, karena protein ini terlibat pada degradasi (genotipe
rentan) maupun pada sintesis (genotipe toleran) pati pada saat pengisian biji.
Majoul et al. (2003, 2004) mengungkapkan bahwa penurunan tingkat dua
enzim kunci, glucose-1-phosphate adenyl-transferase dan granule bound starch
synthase pada tahap pengisian biji yang berakibat kurangnya hasil biji di bawah
kondisi cekaman panas menunjukkan peran enzim ini . Namun peranan
dari proteomik dalam memahami secara rinci jalur metabolik gandum yang
terkena dampak cekaman panas dan identifikasi kandidat enzim sebagai target
potensial dalam merakit gandum toleran cekaman panas belum sepenuhnya
dipahami.
Metabolomik. Tanaman menanggapi cekaman abiotik dengan mengubah
komposisi dan konsentrasi metabolit sehingga dapat beradaptasi dengan
perubahan lingkungan yang merugikan. Dalam konteks ini, profil metabolit
global dapat memainkan peran penting karena berpeluang memantau
prekursor secara simultan, intermediet, dan merupakan produk dari semua
jalur metabolik dari organisme tanaman apa pun (Kaplan et al. 2011). Profil
metabolik telah mempercepat penemuan molekul sinyal transduksi terhadap
cekaman dan senyawa yang merupakan bagian yang tidak terpisahkan dari
respon tanaman cekaman abiotik (Shulaev et al. 2008). Namun, hanya sedikit
informasi yang tersedia mengenai profil metabolik gandum, dan tidak satu pun
dari informasi ini yang terkait dengan cekaman panas (Matthews et al.
2012). Sejak protein dan karbohidrat merupakan metabolit utama pada
membentukan biji gandum, sebagian besar studi terdahulu terfokus hanya pada
senyawa ini dibandingkan dengan seluruh perubahan metabolit sebagai
respon terhadap cekaman panas. Oleh karena itu perlu menganalisis profil
metabolit global di bawah cekaman panas yang melibatkan kelompok heterogen
molekul penanda yang terlibat dalam jaringan metabolisme yang kompleks.
TANTANGAN PENGEMBANGAN VARIETAS GANDUM
Pada tahun 2050, diperkirakan permintaan gandum meningkat sekitar 60% untuk
memenuhi kebutuhan yang terus meningkat (Rosegrant and Agcaoili 2010).
Pada saat yang sama, peningkatan suhu yang disebabkan oleh perubahan iklim
diperkirakan akan menurunkan produksi gandum di negara berkembang
sebesar 20-30%. Kecenderungan produksi berkaitan dengan penurunan potensi
hasil gandum di daerah penghasil utama karena terjadinya perubahan iklim.
Belakangan ini, beberapa penanda molekuler yang berhubungan dengan
toleransi panas telah dikembangkan. Skrining plasma nutfah gandum untuk
toleransi cekaman suhu panas menggunakan pendekatan alat bantu penanda
seleksi (MAS) untuk gen yang diketahui toleran dapat menjadi pendekatan yang
tepat dalam membantu pemulia konvensional untuk mengembangkan gandum
toleransi cekaman suhu panas. Hal ini berperan penting dalam meminimalisasi
kehilangan hasil.
Genom gandum adalah hexaploid yang berukuran besar, sekitar 16 Gbp
(Arumuganathan and Earle 1991). Faktor ini merupakan penghambat dalam
pengembangan penanda molekuler pada gandum. Menurut Elshire et al. (2011),
pendekatan baru untuk genotyping menggunakan alat next generation
sequencing (NGS) efektif menghasilkan penanda genom wide high-througput
dengan biaya yang relatif murah. Genotipe-by-sequencing (GBS) memanfaatkan
enzim restriksi untuk menangkap representasi yang mengalami pengurangan
target genom dan adaptor DNA barcode untuk urutan beberapa sampel (96-
384) yang sekali jalan secara paralel sesuai platform NGS (multiplexing). GBS
saat ini telah banyak diaplikasikan secara luas pada genom barley (Hordeum
vulgare L.) dan gandum untuk menghasilkan penanda molekuler secara cepat
(Poland et al. 2012).
Selain itu, pendekatan genomik, proteomik, dan transcriptomik dalam
memahami mekanisme toleransi cekaman panas juga diperlukan. Pemahaman
akan molekuler tentang mekanisme respon dan toleransi akan membuka jalan
bagi perakitan tanaman yang memiliki toleransi terhadap cekaman panas.
Respon cekaman panas penting artinya, khususnya untuk tanaman yang
merupakan ekspresi HSPs dan beberapa protein terkait cekaman lainnya yang
juga tersedia. Respon tanaman terhadap cekaman tunggal dan cekaman
kombinasi berbeda pada tingkat molekuler. Dengan demikian strategi alternatif
diperlukan dalam perakitan varietas tanaman yang mengalami kombinasi
cekaman dibanding cekaman tunggal.
Meskipun studi molekuler berpeluang membantu meningkatkan hasil yang
bernilai ekonomi, namun hasil yang lebih mendekati adalah estimasi terbaik di
tingkat fenotipik tanaman. Jadi sistem pemodelan tanaman mungkin diperlukan
dalam hubungannya dengan studi biologi untuk meningkatkan hasil panen.
Ekspansi yang cepat dalam pemahaman tentang kontrol genetik dari sifatsifat utama dalam mengendalikan ketahanan terhadap penyakit, toleransi
terhadap cekaman dan komponen kualitas abiotik telah mengubah metode
melalui aplikasi penanda molekuler dalam program pemuliaan. Tampilan
penanda yang menawarkan alternatif cepat dan murah untuk bioassay telah
sukses dan berkontribusi dalam mempercepat dan meningkatkan efisiensi
seleksi. Namun, strategi ini tidak sepenuhnya memanfaatkan teknologi untuk
struktur genom gandum dan barley. Keterbatasan utama usaha peningkatan
dan kompleksitas pemakaian marker adalah besarnya populasi maksimal yang
diperlukan jika ingin mencoba menyeleksi alel pada sejumlah besar lokus secara
bersamaan dan pemahaman yang umumnya relatif kurang mengenai perilaku
rekombinasi. Beberapa daerah genom di mana rekombinasi tidak terjadi seperti
yang diharapkan seringkali tidak efektif memanfaatkan alel yang diinginkan dari
kerabat liar atau landrace. pemakaian marka secara konvensional belum efektif
memanfaatkan daerah genom ini .
Tantangan utama dalam pemuliaan seluruh genom adalah bagaimana
menggunakan informasi genom, memahami struktur haplotype dan perilaku
rekombinasi, mengetahui lokasi utama sejumlah lokus dan marka penanda untuk
alel yang diinginkan dan tidak diinginkan, merancang strategi pemuliaan optimal
yang mengintegrasikan sebanyak mungkin informasi yang tersedia. Pendekatan
ini memiliki potensi yang secara dramatis mengubah metode dimana plasma
nutfah dikelola untuk meningkatkan fleksibilitas program pemuliaan.
Seleksi atau pemilihan tanaman oleh manusia menjadi awal ilmu pemuliaan
tanaman. Seleksi dilakukan bila ada keragaman pada populasi tanaman.
Sebelum abad ke-20, seleksi tanaman menggunakan segregan silang dan
mutan-mutan alam dalam perbaikan sifat tanaman. Alam menyediakan
keragaman genetik. Selain dari tanaman, persilangan alam juga terjadi dengan
mutasi spontan yang tidak melibatkan campur tangan manusia. Mutasi
merupakan salah satu sumber variasi genetik pada makhluk hidup. Variasi
berfungsi untuk menyediakan populasi dasar untuk seleksi alam dan bagian
integral dalam evolusi.
Tanaman mutan dapat menunjukkan efek besar atau kecil terhadap sifat
fenotipe, bergantung pada gen yang mengalami mutasi. Banyak mutasi mungkin
merusak yang memicu suatu organisme menjadi kurang beradaptasi
terhadap lingkungannya dan beberapa mungkin bersifat letal. Namun mutasi
gen dapat menghasilkan genotipe baru yang bermanfaat melalui proses
segregasi bebas dan crossing over antara gen. Seleksi mutasi spontan telah
dimulai sejak 300 tahun SM di Cina (Harten 1998a). Di akhir abad ke-19, Hugo De
Vries menemukan pola pewarisan sifat yang tidak mengikuti hukum pewarisan
Mendel. Pada tahun 1901 dia menemukan mutasi sebagai mekanisme yang
menghasilkan variabilitas dan menetapkannya sebagai suatu perubahan
terwariskan dengan suatu mekanisme yang sangat berbeda dengan rekombinasi
dan segregasi. Dia menyebut kejadian ini dengan istilah “mutasi” dan
mempresentasikan suatu konsep integratif mengenai perubahan yang terjadi
secara tiba-tiba pada suatu sifat, yang memicu terbentuknya suatu spesies
baru dan munculnya keragaman (Kharkwal 2012).
Konsep mutasi Hugo de Vries sebagai sumber keragaman genetik dan ideidenya tentang potensi tanaman mutasi untuk pemuliaan tanaman, dijadikan
sebagai tonggak awal teknologi mutasi dalam disiplin ilmu pemuliaan. Hugo de
Vries juga mengusulkan di dalam publikasinya pada tahun 1901 dan 1903 bahwa
tipe radiasi baru seperti sinar X dan Gamma yang ditemukan oleh Konrad Van
Roentgen (1895), Henry Becquerel (1896), dan Pierre serta Marie Curie (1897/
1898) mungkin sangat bermanfaat untuk menginduksi mutasi buatan (Kharkwal
2012).Mutasi digambarkan sebagai perubahan tiba-tiba pada genetik makhluk hidup
yang mampu menunjukkan perubahan fenotipe tanaman dan dapat diturunkan.
Sebelum tahun 1950an penelitian pemuliaan berbasis pada perubahan fenotipe.
Dari pertengahan tahun 1950-an dan setelahnya, mikroskopi menyediakan
observasi aberrasi pada tingkat ploidi, kariotipe dan kromosom. Saat ini mutasi
dapat dideteksi pada tingkat sekuens DNA. Karena sejalan dengan material
genetik, mutasi dapat ditemukan pada seluruh konstitusi selular yang membawa
DNA, seperti nukleus, mitokondria, dan plastid. Klasifikasi mutasi bervariasi
berdasarkan metode deteksi yang digunakan yaitu:
1. Stubbe (1938) membagi mutasi menjadi tiga kelas; 1) genom, 2) plastidom
(semua plastida di sitoplasma sel), dan 3) plasmon (total sistem sitoplasmik
eukariotik, mitokondria dan plastida). Mutasi genom dibagi menjadi genom,
kromosom dan gen.
2. Gustafsson dan Ekberg (1977) mengkategorikan mutasi menjadi: 1) mutasi
genom, 2) mutasi kromosom dan, 3) mutasi ekstra nuklear
3. Auerbach (1976) mengklasifikasikan mutasi menjadi: 1) perubahan jumlah
kromosom, 2) mutasi intergenik, dan 3) mutasi intragenik.
4. Harten (1998b) mengklasifikasikan mutasi menjadi; 1) mutasi inti dan luar
inti, 2) mutasi spontan dan induksi, 3) mutasi makro dan mikro, 4) mutasi
fenotipe.
Klasifikasi pada Tingkat Fenotipe
Keragaman muncul pada fenotipe tanaman akibat terjadinya mutasi. Mutasi
fenotipe menjadi perhatian pemulia tanaman karena mutasi menunjukkan
karakter tanaman yang dapat memiliki nilai ekonomi. Pemuliaan tanaman
merupakan suatu proses seleksi berdasarkan fenotipe. Populasi mutasi yang
besar dapat dikembangkan dan digunakan untuk penelitian pemuliaan tanaman
yang dikerjakan berdasarkan fenotipe tanaman. Pada tanaman serealia, kelas
mutasi yang paling umum pada penampilan fenotipe tanaman umumnya terlihat
pada warna daun, tinggi tanaman, sterilitas, dan pertumbuhan.
Klasifikasi pada Tingkat Genotipe
Genom terdiri atas set-set kromosom dasar dan sering diberi simbol spesifik.
Tanaman diploid diberi simbol ganda seperti untuk Barley, Hardeum vulgare
yaitu HH. Pada beberapa spesies genom ganda menghasilkan autoploid.
Beberapa spesies poliploidy tersusun dari genom yang berbeda dan dikenal
sebagai alloploidy. Sebagai contoh, gandum durum merupakan tetraploid
dengan dua genom diploid, AA BB, dan gandum heksaploid dengan tiga genom
diploid, AA BB DD. Poliploidi menjadi mekanisme evolusi pada tanaman dan
telah banyak dimanfaatkan pada beberapa spesies tanaman budi daya, seperti
tebu, kapas, pisang, kacang tanah, dan kentang.
Mutasi Ploidi
Mutasi ploidi tipe defisiensi termasuk pengurangan jumlah genom, seperti barley
diploid (HH) menjadi barley haploid (H). Tanaman haploid dapat menghasilkan
haploid ganda sehingga menghasilkan galur homozigot, yang merupakan
teknologi alternatif dalam pemuliaan dan genetika tanaman pada banyak
spesies. Haploid ganda dapat diperoleh dengan menginduksi embriogenesis
pada sel kultur haploid, untuk menghasilkan genom ganda. Pada beberapa
spesies tanaman terdapat mekanisme alami yang dapat memacu pengurangan
ploidy. Sebagai contoh, gen penginduksi haploid pada jagung dan barley
meningkatkan frekuensi embrio haploid pada biji (Barret et al. 2008, Finch 1989).
Ravi dan Chan (2010) memperoleh tanaman haploid dengan teknik eleminasi
genom yang dimediasi oleh centromer.
Penambahan genome, poliploidi dengan cara duplikasi (autoploid) atau
penambahan genom (alloploid) terjadi secara alami dalam proses evolusi
spesies tanaman dan juga memugkinkan diinduksi secara buatan. Salah satu
efek dari poliploidi adalah meningkatkan volume nukleus, yang juga
meningkatkan ukuran sel, jaringan, dan organ tanaman.
Alloploid memiliki tambahan genom berbeda yang mengandung gen-gen
yang berbeda, untuk memperkaya keragaman gen dalam proses dan peluang
meningkatkan heterosis (Lundqvist et al. 2012). Beberapa contoh tanaman
poliploid adalah:
1. Triploid: pisang, semangka, dan apel.
2. Tetraploid: randu, kubis, gandum durum, kentang, dan tembakau.
3. Hexaploid: gandum terigu, oat, triticale, dan krisan.
4. Oktaploid : dahlia dan strawberi.
Mutasi Kromosom
Kromosom merupakan organ dalam nucleus sebagai tempat kedudukan gengen secara bersama-sama, yang juga dikenal sebagai kelompok pautan (lingkage
group). Kromosom memiliki dua lengan yang panjangnya seimbang atau tidak,
yang bersatu pada centromer. Setiap spesies normalnya memiliki set kromosom
standar yang disebut euploid. Genom dari euploid yang tidak normal diistilahkan
aneuploid yang merupakan penambahan atau kehilangan satu atau lebih
kromosom atau bagian kromosom. Duplikasi dan delesi, khususnya hilangnya
bagian dari kromosom, tidak dapat ditoleransi oleh kebanyakan spesies diploid.
Beberapa diploid mentoleransi penambahan kromosom, tetapi duplikasi
ini sering menghilang selama proses meosis. Pada generasi selanjutnya,
aneuploid kembali ke euploid. Poliploid memiliki lebih banyak pengendali
genetik dan tanaman aneuploid viable dapat diproduksi dari poliploid (Lundqvist
et al. 2012)
Mutasi Gen
Mutasi gen dapat dibagi berdasarkan perubahan dalam jumlah dan komposisi
gen, yang terdiri atas:
1. Mutasi jumlah copy gen
Jumlah copy gen (paralogus) dapat meningkat dan menurun oleh mutasi
spontan atau induksi. Duplikasi suatu gen dapat terjadi pada lokus mana pun
dalam genom meskipun kebanyakan terjadi pada kromosom homologus. Mutasi
yang mempengaruhi jumlah copy gen dapat menurunkan atau meningkatkan
ekspresi gen yang menghasilkan sifat tertentu. Perubahan dalam mutasi jumlah
copy gen biasanya berasal dari suatu produk kesalahan perpasangan selama
proses meosis dan rekombinasi. Namun, peristiwa mutasi yang umum adalah
penurunan jumlah copy gen yang efektif, disebabkan oleh mutasi titik.
2. Mutasi tak terstruktur: perubahan pada sekuens DNA
Kategori ini melibatkan perubahan dalam sekuens pasangan basa dari DNA.
Mutasi juga disebabkan oleh perubahan pada daerah yang tidak dikodekan
(non coding region) seperti promoter, intron, heterokromatin dan DNA repetitif.
Mutasi gen nonstruktural yang umum terjadi adalah sebagai berikut:
a. Mutasi titik: umumnya diakibatkan oleh mutagen kimia. Mutasi ini
melibatkan perubahan basa tunggal dan dapat menghasilkan kodon missense (code untuk asam amino yang berbeda), silent (diam, tidak ada
perubahan asam amino), dan nonsense (kodon asam amino berubah).
Mutasi titik juga dikenal sebagai subsitusi basa tunggal, yang berkontribusi
terhadap polimorfisme nukleotida tunggal (SNP), insersi dan delesi satu
atau lebih nukleotida. Penggabungan keduanya disebut InDel, dapat
menghasilkan perubahan kodon dan frameshift pada codon reading frame
dengan efek kuantitatif dan kualitatif pada produksi protein. Mutasi pada
daerah spesifik gen, seperti promoter, daerah pengkodean, stop, intron
dan sekuens 3' yang tidak ditranslasi, insersi transposon, juga dikenal
sebagai mutagenesis insersi. Transponson merupakan sekuens DNA yang
dapat berpindah, masuk atau keluar dari kromosom. Biasanya transposon
aktif karena stres lingkungan dan aktivitasnya dapat mematikan atau
mengaktifkan gen dengan masuk ke dalam gen.
b. Mimik mutasi: Keadaaan lingkungan tumbuh yang tidak teratur dari proses
fisiologi yang beragam dapat menghasilkan mutan fenotipik. Namun hal ini
bukan bersifat genetik dan dapat dibedakan dari mutasi sebenarnya dengan
tidak adanya pewarisan sifat kepada keturunannya. Banyak efek epigenetik
yang kurang dipahami dan istilah ini digunakan untuk banyak
penyimpangan fisiologi yang disebabkan faktor lain yang bukan genetik.
Untuk memberikan pemahaman yang baik tentang hal ini adalah
metilasi DNA yang dapat mengganggu ekspresi gen normal. Metilasi
merupakan penyimpangan yang umum terjadi pada DNA tanaman yang
dibiakkan dalam kultur jaringan. Beberapa perubahan epigenetik dapat
diwariskan pada saat pola metilasi tidak secara sempurna diperbaiki di gamet
dan setelah fertilisasi.
Banyak jenis mutagen yang dapat digunakan dalam menghasilkan keragaman
atau menimbulkan mutasi induksi pada tanaman. Namun secara garis besar,
jenis mutagen ini dapat dikelompokkan kedalam dua kelompok besar,
yaitu mutagen fisik (agen fisik) dan mutagen kimia (agen kimia). Kedua jenis
mutagen ini tidak hanya berbeda dari segi bahan bakunya, namun juga
memiliki efek yang berbeda.
Mutagen Fisik
Mutagen fisik dapat memicu kerusakan pada molekul-molekul DNA
organisme hidup. Di awal abad ke-20, penemuan kembali hasil penelitian Gregor
Mendel yang dikenal sebagai genetika Mendel, sangat dekat dengan pemahaman
teori bahwa mutasi, perubahan terwariskan, dan menyusun suatu individu dapat
diinduksi. Mutasi induksi dapat berupa mutasi mimik spontan, yang
mengendalikan evolusi dan spesiasi. Kebanyakan mutagen fisik adalah radiasi
ionisasi dan telah digunakan secara luas untuk menginduksi penyimpangan
hereditas dan lebih dari 70% mutan dikembangkan dari mutagenesis fisik.
Tipe dan Efek Radiasi Mutagenik
Radiasi didefinisikan sebagai energi yang berpindah dalam bentuk gelombang
atau partikel. Radiasi dibagi menjadi dua kategori, yaitu radiasi elektromagnetik
dan korpuskular, untuk membedakan jenis radiasi partikel dan gelombang.
Radiasi elektromagnetik diklasifikasikan lebih lanjut berdasarkan sumbernya
dan yang paling membedakan adalah jumlah energi yang terlibat, frekuensi
dan sumbernya. Mutagen fisik yang dimaksud adalah sinar X, sinar gamma,
neutron, partikel beta, partikel alfa dan proton atau deutron. Tipe mutagen fisik,
sumber, deskripsi, energi dan daya tembus disajikan pada Tabel 1.
Radiasi Ionisasi dan Nonionisasi
Berdasarkan kapasitasnya untuk menghasilkan ion, radiasi dibagi menjadi
radiasi ionisasi dan non-ionisasi. Radiasi non-ionisasi kuat mempengaruhi atom,
namun tidak cukup kuat mempengaruhi strukturnya. Sebaliknya, radiasi ionisasi
memiliki energi yang cukup untuk secara langsung mempengaruhi struktur
atom dan material, termasuk makhluk hidup. Istilah ionisasi muncul dari fakta
bahwa ketika bentuk radiasi melalui suatu jaringan, selalu ada kecendrungan
untuk mengeksitasi suatu elektron dari orbitnya di sekitar nukleus, sehingga
menghasilkan ion sebagai proton yang terionisasi.
Untuk memahami cara kerja mutagen fisik yang berbeda, pengetahuan
peran sentral atom diperlukan. Semua zat terdiri atas atom, terutama ruang.
Tiga partikel atom adalah proton, neutron, dan elektron. Di tengah atom adalah
neutron dan proton yang sangat kuat ikatannya dan bermuatan positif,
sedangkan elektron bermuatan negatif dan berada pada orbit nukleus. Jumlah
proton dalam nukleus unik dan menentukan elemen atom ini . Sebagai
contoh, jika suatu nukleus mengandung delapan proton, maka atom ini
adalah oksigen, dan jika mengandung 17 proton, atom ini adalah klorin.
Jumlah neutron dalam nukleus seluruh atom dari zat tertentu tidak pasti.
Laju dosis dan satuan dosis bergantung dari besarnya aktivitas jenis
radioisotop sebagai sumber pengion, salah satu contoh yang paling sering
digunakan adalah Co60, yaitu radioisotop yang memancarkan sinar gamma.
Makin tinggi aktivitas Co60 makin tinggi laju dosisnya. Laju dosis adalah jumlah
dosis terserap per satuan waktu (rad/detik atau Gy/detik). Satuan dosis terserap
adalah rad atau gray (Gy) misalnya 1 rad = 100 erg/g materi, 1 Gy = 100 rad = 1
joule/kg materi. Pengaruh laju dosis pada pemuliaan mutasi masih belum ada
kesamaan pendapat. Laju dosis, satuan dosis dan lamanya penyinaran sinar
gamma disajikan pada Tabel 2.
Terdapat beberapa teknik meradiasi dalam pemuliaan mutasi dengan
menggunakan mutagen fisik, yaitu radiasi akut, teknik meiradiasi dengan laju
dosis yang tinggi sehingga waktu iradiasi hanya dalam hitungan detik, menit
atau beberapa jam. Radiasi kronik adalah teknik meiradiasi dengan laju dosis
yang rendah atau sangat rendah, sehingga waktu meiradiasi dapat berharihari, berbulan-bulan bahkan bertahun-tahun. Teknik ini hanya dapat dilakukan
bila ada kebun gamma. Radiasi berulang adalah teknik meiradiasi dengan
berulang 2-3 kali dengan dosis yang sama pada materi pemuliaan yang sama
dengan selang waktu yang sama atau berbeda. Radiasi bertahap adalah teknik
meiradiasi berulang yang dosisnya makin lama makin tinggi atau makin rendah.
Dengan teknik meiradiasi bertahap ini, materi pemuliaan dapat menerima dosis
iradiasi yang lebih tinggi dibandingkan dosis iradiasi tunggal
Mutagen Kimia
Mutagen kimia adalah senyawa kimia yang dapat menimbulkan mutasi. Senyawa
kimia mudah terurai, membentuk radikal yang aktif, dan dapat bereaksi dengan
asam amino dalam DNA sehingga terjadi perubahan genetik. Jenis mutagen
kimia yang sering digunakan dalam pemuliaan mutasi tanaman adalah EMS
(Ethylene methane sulphonat), dES (diethyl sulphate), EI (ethyleneimine), ENU
(ethyl nitroso urethane), ENH (ethyl nitroso urea), NMU (Nitroso methyl Urea),
MNH (methyl nitroso urea), dan NTG (Nitrosoguanidine)
Dosis mutagen kimia
Dosis perlakuan dengan mutagen kimia sebenarnya sama dengan dosis pada
perlakuan dengan radiasi fisik atau pengion yaitu ditentukan oleh konsentrasi
mutagen kimia dalam larutan dan lama perlakuan. Terdapat tiga faktor yang
berpengaruh terhadap hasil perlakuan dengan mutagen kimia, yaitu konsentrasi
dengan menggunakan mutagen kimia bertanda (14C-EMS22atau 14C-MMS22), lama
perlakuan, dan suhu. Penyerapan mutagen kimia dalam biji mengikuti hukum
difusi selama konsentrasi mutagen lebih tinggi dari konsentrasi cairan dalam
sel biji, Lama perlakuan adalah lama perendaman larutan mutagen kimia terkait
dengan konsentrasi suhu waktu perlakuan dan kondisi fisiologis biji. Suhu erat
kaitannya dengan waktu paruh mutagen kimia. Suhu ruang tempat perlakuan
disarankan 20–25OC, sebab pada suhu ini mutagen tidak cepat terhidrolisis
sehingga perlakuan dapat lebih lama berlangsung.
Objek Pelakuan Mutagen
Objek perlakuan mutasi baik menggunakan mutagen fisik (pengion) maupun
mutagen kimia, materi pemuliaan mutasi dapat berupa tanaman, biji/benih,
tepung sari, jaringan maristem (umbi, stek, tunas, stolon), dan sel/kultur jaringan/
kallus. Objek perlakuan mutagen fisik memiliki perbedaan radiosensitivitas yang
besar dari setiap bagian tanaman, bergantung pada kondisi fisiol
Langganan:
Komentar (Atom)

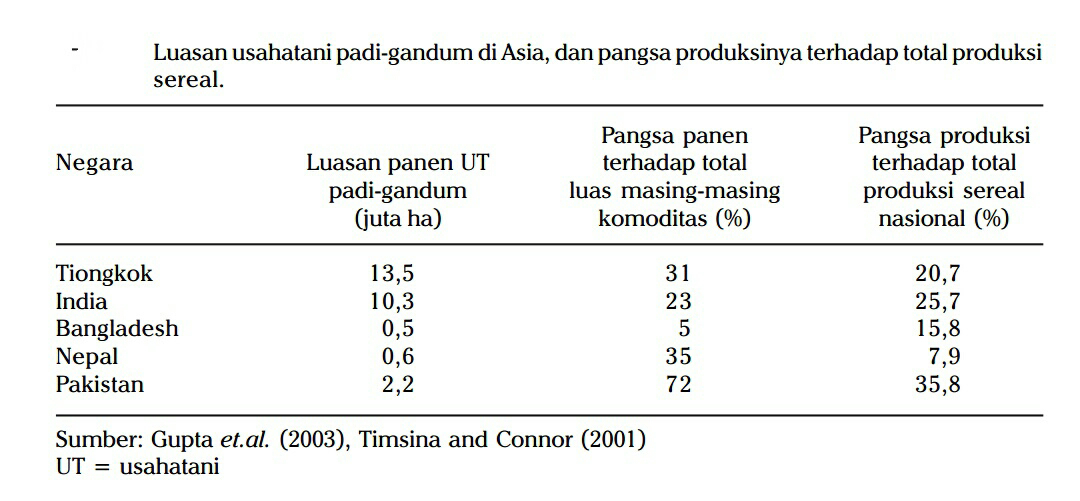





.jpg)




